Ваальс
Cтраница 2
Ваальса, а только уравнение ( 22), поскольку оно при больших v является их приближенно верным выражением, при меньших же v дает по крайней мере качественное совпадение. [16]
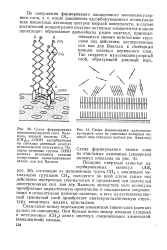
Ваальса, вследствие чего молекулы приобретают параллельную ориентацию и оказываются соединенными в относительно прочные пакеты, а весь мультимолекулярный граничный слой приобретает квазикристаллическую структуру комплекса жидких кристаллов. [18]
Ваальса, оба же мнимых корня в этом случае физического смысла не имеют и должны быть отброшены. Тело в этом случае при любых давлениях находится в газообразном состоянии. [19]
 |
Давления р ( в бар Н2 и СО, при 100 С. [20] |
Ваальса и отличается от него только введением температуры в первый поправочный член с целью ослабления указанной выше изменяемости постоянной а с температурой. [21]
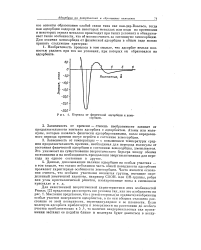 |
Переход от физической адсорбции к хемосорбции. [22] |
Ваальса, тогда как адсорбция водорода на некоторых металлах или воды на кремнеземе и некоторых окисях металлов происходит при таких условиях и обнаруживает такие особенности, что ее можно считать за истинную хемосорбцию. [23]
Ваальса, учитывающая ассоциацию молекул и соответствующая коэффициенту х; с, т - дополнительные константы, различные для разных газов; a, b - постоянные Ван-дер - Ваальса. [24]
Ваальса силы Межъядерное расстояние 114, 118 Менделеева периодическая система элементов 84 ел. [25]
Ваальсу ( и и а - соответствующие коэффициенты), дополнительно принято во внимание отталкивание атомов и ионов ( электронов) на малых расстояниях - введен коэффициент 6; коэффициенты aaf и аа. AFf учитывает возможное вырождение электронов; I - потенциал ионизации. [26]
Ван-дер Ваальса и лучше отражает свойства реальных газов. [27]
Ван-дер - Ваальс, исследуя свойства реальных газов, установил, что для всех веществ сходственными являются их критические точки. Действительно, координаты критической точки ( критические температура Тс, давление рс и мольный объем Vc) в большинстве случаев удовлетворяют требованиям, предъявляемым к единицам, выбранным при вычислении значений инвариантов подобных систем. [28]
Ван-дер - Ваальс [2] подошел к определению понятия фазы своеобразно. Он сначала ввел понятие о телесных комплексах, подразумевая под этим однородные части системы, которые пространственно разделены и которые можно из нее удалить. Например, если система состоит из смеси льда с водой, то каждый отдельный кристаллик льда, так же как и вода, будет представлять собой телесный комплекс. Совокупность телесных комплексов, химический состав и интенсивные и экстенсивные, отнесенные к единице фазы, термодинамические свойства которых вполне одинаковы, и представляет собой фазу. [29]
Ван-дер - Ваальс ( 1889), исследуя свойства реальных газов, установил, что такими соответственными точками являются их критические точки. [30]
Страницы: 1 2 3 4