Ваальс
Cтраница 3
Ван-дер - Ваальс [30] - первый ученый, рассмотревший причины существования или исчезновения минимума и максимума при критическом состоянии смесей. Павловский [20] провел много экспериментов ( в запаянных капиллярах, практически при V const) и сформулировал правило, позволяющее предсказать поведение жидкой бинарной смеси в критическом состоянии. Он обнаружил, что в простейшем случае существует линейная зависимость между возрастанием критической температуры и увеличением концентрации компонента, имеющего более высокую критическую температуру. В настоящее ьремн известны многочисленные примеры, показывающие большое отклонение от этого правила. [31]
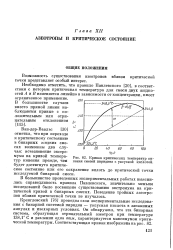 |
Кривая критических температур кипения смесей пиридина с уксусной кислотой. [32] |
Ван-дер - Ваальс [30] отметил, что при переходе к критическому состоянию в бинарных жидких смесях возможны два случая: исчезновение экстремума на кривой температур кипения прежде, чем будет достигнуто критическое состояние или его сохранение вплоть до критической точки исследуемой бинарной смеси. [33]
Ван-дер - Ваальс [1] и Дитеричи [2] предложили основную форму многих уравнений состояния, используемых в настоящее время. Редлих, Квонг [3] иКейес [4] также разработали некоторые аналитические выражения подобного типа. Бенедикт, Вебб и Рубин модифицировали уравнение Битти - Бриджмена, чтобы получить аналитическое выражение, которое характеризовало бы, помимо всего прочего, объемное поведение в точках кипения. Следует отметить, что уравнение БВР было выведено главным образом с целью описания фазового поведения многокомпонентным углеводородных смесей с относительно низким молекулярным весом. [34]
Ван-дер - Ваальс и Платто [300] изучали термодинамические свойства клатратов, пользуясь простой моделью, соответствующей трехмерному обобщению идеально локализованной адсорбции. [35]
Ван-дср - Ваальс [297] недавно отметил, что невозможно строго записать значение потенциальной энергии клатратировапных молекул в виде суммы значений координат положения и ориентации. [36]
Ван-дер - Ваальс не делал каких-либо предположений о природе сил межмолекулярного взаимодействия. Но он пришел к выводу, что межмолекулярные силы в газах и жидкостях по своей природе должны быть одинаковыми. Основанием для этого важного заключения послужило сущесавование непрерывного перехода от жидкости к газу, а также тот факт, что уравнение (3.17) оказалось пригодным для качественного описания свойств не только газов, но и жидкостей. [37]
Ван-дер - Ваальс нашел, что поправка b на собственный объем молекул, имеющих шарообразную форму, равна учетверенному объему молекул. [38]
Ван дер Ваальс И. [39]
Ван-дер - Ваальс применил эту модель к клатратным соединениям использовав параметры межмолекулярдых сил, полученные из вторых вириальных коэффициентов для газа, рассмотренных наряду с приемлемыми величинами для констант межмолекулярных сил взаимодействия между двумя элементами стенки ячейки. [40]
Ван-дер - Ваальс и Платеев [109, 110] в настоящее время показали, что некоторые клатратные соединения гидрохинона и гидратные клатратные соединения термодинамически соответствуют идеализированной ячеечной модели растворов по Леннарду-Джонсу и Девонширу. [41]
Ван-дер - Ваальс, Орнштейн, Цернике, Вейсс) сумели уловить некоторые существенные стороны явления. Весьма простые теории, сформулированные ими, д сейчас еще используются для сравнения и как исходный пункт в современных исследованиях. Однако нельзя ожидать, что классические теории ( как их теперь называют) смогут описать все аспекты фазовых переходов и критических явлений. Это стало совершенно ясным после важных работ Каца, Уленбека, Хеммера, Лебовитца, Пенроуза и Либа, обсуждавшихся в разд. Оказалось, что классические теории описывают системы частиц, взаимодействующих посредством сил притяжения, радиус действия которых бесконечен, что совершенно не соответствует реальным силам. [42]
Ван-дер - Ваальс модифицировал закон состояния идеального газа, npHHHBjK внимание оба указанных фактора. Уравнение Ван-дер - Ваальса ( Р ajV2) ( V - b) ЯТдля 1 моля газа включает экспериментально определяемую постоянную Ь, которая связана с объемом молекул, и постоянную а. По данным о значениях вандер-ваальсовой постоянной b можно получить приближенную оценку диаметра молекул, и такие оценки грубо согласуются с оценками молекулярных диаметров по плотности кристаллических веществ или по данным о вязкости газов. [43]
Ван дер Ваальс Я. [44]
Ван-дер - Ваальс получил уравнение состояния реального газа, учитывающее конечность объема молекул и. [45]
Страницы: 1 2 3 4