Алифатический заместитель
Cтраница 2
Если бы для алифатических заместителей влияние индукционного эффекта строго подчинялось закономерностям однородного взаимодействия и не было связано с какими-либо аномальными явлениями, можно было бы ожидать, что и в случае алициклических соединений мы не встретимся с какими-либо неожиданностями. Индукционные постоянные алициклических заместителей можно было бы просто вычислить, исходя из дан-132 ных для алифатических систем. [16]
Ими установлено, что алифатические заместители у карбонильной группы повышают потенциал восстановления соединения причем, чем длиннее углеродная цепь, тем сильнее смещается потенциал восстановления в область отрицательных потенциалов; напротив, введение электроотрицательных заместителей, например фениль-ных групп, облегчает восстановление. Еще сильнее снижают потенциал восстановления галогены и конденсированные кольца. Действие заместителей тем сильнее, чем ближе они расположены к карбонильному атому углерода. Это легко объясняется тем, что заместители в а-положении в зависимости от своей природы влияют на полярность связи С О, увеличивая или уменьшая ее. [17]
При рассмотрении индукционного влияния алифатических заместителей особое внимание для выяснения степени соблюдения предполагаемого постоянства факторов zl для атома углерода ( метиленовой группы) было уделено проводимости индукционного эффекта через полиметиленовую цепочку. Точно такая же проблема возникает и в случае передачи индукционного влияния замещенных фенилов. [18]
Введение в молекулу акрилонитрила алифатических заместителей особенно заметно повышает потенциал восстановления и затрудняет процесс димеризации. Например, 1 2 2-триметилакрилонитрил не образует димерного продукта даже в растворах четвертичных солей аммония. В щелочных растворах наилучший выход гидродимера наблюдается при электровосстановлении акрилонитрила. Введение метильной группы как в а -, так и в [ 3-положение существенно снижает выход димера, причем присутствие метильной группы в а-положении значительно более резко подавляет процесс гидродимеризации. Такое поведение находит объяснение с точки зрения ионной схемы восстановления нитрилов. [19]
Таким образом, накопление алифатических заместителей в молекуле восстанавливаемого вещества препятствует образованию димерного продукта и выход мономерного дигидросоединения независимо от условий электролиза существенно возрастает. [20]
О димеризации циклопентадиенонов, имеющих алифатические заместители, сведений пока еще мало, но их поведение в конденсации, по-видимому, аналогичное. [21]
Рассмотрим теперь ароматические вещества без алифатических заместителей. Как следует из сравнения нафталина [49] с а-нафтолом [12] и а-нафтиламином [14], введение окси - или аминогруппы в молекулу резко ухудшает ее совместимость с ПЭ. [22]
Экснер [44], использовав константы алифатических заместителей, коррелировал кислотности а-замещенных толуиловых кислот, а Норман [45] - реакции нитрования производных толуола. [23]
Наличие в звеньях макромолекул полимера боковых алифатических заместителей препятствует тесному сближению отдельных цепей. С увеличением размера групп заместителя структура полимера становится более разрыхленной, что приводит к уменьшению сил межмолекулярного сцепления. Присутствие заместителя даже небольшого размера способствует повышению эластичности и морозостойкости полимера, во многих случаях одновременно уменьшается твердость и хрупкость полимера. [24]
Соединения типа VIII известны с ароматическими и алифатическими заместителями. [25]
В этом случае бензольное кольцо не защищает алифатический заместитель. Причина этого интересного явления пока не ясна. [26]
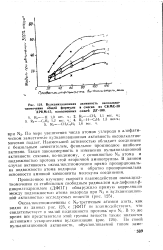 |
Вулканизационная активность оксоалкил-тиомочевин общей формулы в смесях из СКМС-30 APK. M - J5, наполненных сажей ДГ-100. [27] |
По мере увеличения числа атомов углерода в алифатическом заместителе вулканизационная активность оксбалкилтио-мочевин падает. Наименьшей активностью обладает соединение с бензильным заместителем, фенильное производное наиболее активно. Такая закономерность в изменении вулканизационной активности связана, по-видимому, с основностью N3 атома и подвижностью протона этой вторичной аминогруппы. В данном случае активность оксоалкилтиомочевин прямо пропорциональна подвижности атома водорода и обратно пропорциональна основности аминной компоненты молекулы соединения. [28]
В 1947 г. были получены изобензо-фураны, содержащие только алифатические заместители. Более устойчивые производные изобензофурана с ароматическими заместителями в положениях 1 и 3 получены уже довольно давно. [29]
Значительно большее количество работ посвящено синтезу оксициклопентенонов с алифатическими заместителями. Рассмотрение методов синтеза этих соединений отнесено к следующей главе. [30]
Страницы: 1 2 3 4