Аллильное замещение
Cтраница 3
Это и приводит к образованию того незначительного количества брома, которое необходимо для аллильного замещения. Аллильное замещение происходит также при высокой температуре при взаимодействии между олефинами и галогеном. Возможна изомеризация аллильного радикала. [31]
В пром-сти газофазным окислением пропилена получают акролеин, окислит, аммо-нолиз к-рого приводит к акрилонитрилу. При хлорировании при высоких т-рах ( 400 - 600 С) образуются аллилхлориды. Аллильное замещение происходит также при взаимод. Эти р-ции идут по радикальному механизму. [32]
ВТ образования продуктов возрастает по мере увеличения концентрации субстрата и с повышением электродного потенциала. Общий выход изоциа-нидов достигает максимального значения 7 % с ВТ 4 % при доминировании метоксилирования. Продукты аллильного замещения возникают скорее из 3-циклогексенил-катиона ( ЕСЕ-про-дукта), а не из первоначально генерированных катион-радикалов циклогексена. При проведении анодной реакции в ацетонит-риле в присутствии цианида тетраэтиламмония не наблюдается ни цианирования, ни изоцианирования. [33]
Следует упомянуть, что путь 2 представляет собою известный компромисс между прямым винильным замещением фтора и образованием насыщенного аддукта с последующим отщеплением галогенводорода. В ряде случаев, чтобы объяснить образование ненасыщенных продуктов, предлагались оба эти механизма, однако имеющиеся факты не позволяют строго отличить один от другого. В последнем случае не ясно, происходит ли прямое аллильное замещение фтора или ему предшествует гидратация двойной связи. [34]
Второй атом брома поставляется другой бромосодержащей молекулой или ионом. Если концентрация брома достаточно низка, вероятность того, что подходящая частица окажется в непосредственной близости от интермедиата, очень мала. В любом случае интермедиат возвращается в исходное состояние, что открывает путь конкурентной реакции аллильного замещения. Если это рассуждение справедливо, должна существовать возможность бромирования олефина по аллильному положению без конкурентного присоединения даже в отсутствие N-БС или других аналогичных агентов, если поддерживать очень низкую концентрацию брома и удалять НВг по мере образования, с тем чтобы подавить конкурентную стадию присоединения. [35]
Столь малую склонность к полимеризации высших перфторолефинов Адаме и Бови [43] объясняют высокой электроотрицательностью группы CF3, а также низкой способностью фторолефина стабилизовать радикал растущей цепи. В результате сопряжения группы CF3 с двойной связью олефина последняя обедняется электронами. Это сопряжение трифторме-тильной группы с электронно-истощенной л-связью олефинов приводит к подвижности атомов фтора, что проявляется в большой склонности перфторолефинов к аллильному замещению и перегруппировкам. [36]
Радикальное присоединение хлора и брома к алкенам протекает быстро и обратимо при невысоких температурах. При повышении температуры выше 200 С обратная реакция становится столь быстрой, что начинает преобладать тенденция к отрыву атома водорода. Взаимодействие гомологов этилена с галогенами ( С12, Вг2) при высоких температурах ( выше 400 С) ведет только к замещению атома водорода в аллильном положении на галоген и называется аллильным замещением. Двойная связь при этом в конечном продукте сохраняется. [37]
Химия гетероциклических соединений с перфторалкильными группами, представленная в настоящей книге, показывает, с нашей точки зрения, существенные успехи в развитии новых методов и подходов в области синтеза данного класса соединений и широком использовании определенных и специфических свойств перфторолефинов и их производных в процессах формирования гетероциклических систем. Эти результаты, в свою очередь, обеспечивают новые возможности для развития и расширения нашего знания в области органического синтеза фторорганических соединений. Вместе с тем перфторолефины оказываются удобными модельными объектами для решения различных проблем, связанных с нуклеофиль-ными реакциями фторолефинов, таких как выявление соотношения процессов присоединения, винильного и аллильного замещения, применение нуклеофи-льного катализа в реакциях присоединения и циклоприсоединения и т.п. Развитие химии перфторолефинов наряду с чисто практическими результатами во многом определило общие успехи в исследовании фторсодержащих соединений различных классов. [38]
Проблему разброса состава в аллильных сольволитических реакциях можно было бы просто разрешить, если допустить, что один или оба аллильных изомера подвергаются замещению одновременно по двум конкурирующим SNl и S 2 механизмам. Основания для того, чтобы отвергнуть эту возможность и принять, что реакция протекает по механизму, промежуточному между предельными SNl и SN2, уже обсуждались. Сольволиз несимметричных аллильных соединений по промежуточному механизму дает смесь изомерных продуктов с большим преобладанием продукта без перегруппировки, чем смесь продуктов, получаемая по предельному S i механизму. Если промежуточный механизм включает активное промежуточное соединение, а не переходное состояние, это промежуточное соединение должно отличаться некоторым образом от свободного мезомерного карбониевого иона предельного механизма. Трудно представить промежуточное соединение, отличное от карбониевого иона, и в этом - главный камень преткновения в применении гипотезы о пограничном механизме к реакциям аллильного замещения. [39]
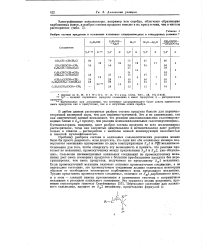 |
Разброс состава продуктов в сольволизе аллильных хлорпроизводных в стандартных условиях. [40] |
Проблему разброса состава в аллильных сольволитических реакциях можно было бы просто разрешить, если допустить, что один или оба аллильных изомера подвергаются замещению одновременно по двум конкурирующим SNl и Sffi механизмам. Основания для того, чтобы отвергнуть эту возможность и принять, что реакция протекает по механизму, промежуточному между предельными SNl и 3 2, уже обсуждались. Сольволиз несимметричных аллильных соединений по промежуточному механизму дает смесь изомерных продуктов с большим преобладанием продукта без перегруппировки, чем смесь продуктрв, получаемая по предельному SNl механизму. Если промежуточный механизм включает активное промежуточное соединение, а не переходное состояние, это промежуточное соединение должно отличаться некоторым образом от свободного мезомерного карбониевого иона предельного механизма. Трудно представить промежуточное соединенье, отличное от SNi карбониевого иона, и в этом - главный камень преткновения в применении гипотезы о пограничном механизме к реакциям аллильного замещения. [41]
Страницы: 1 2 3