Ароматическое замещение
Cтраница 2
При ароматическом замещении для промотирования реакции часто оказывается необходимым присутствие катализатора; его функция состоит в генерировании из данных реагентов электрофильной атакующей частицы. Следовательно, для каждой реакции замещения необходимо установить, что в действительности является атакующим агентом. Этот вопрос менее существен в случае электрофильного присоединения к олефинам, так как последние настолько реакционноспособнее аренов, что применяемые реагенты ( например, Вг2, С12, HBr, HC1, НОС1, НОВг, Н30) сами по себе достаточно электрофильны, чтобы реагировать без помощи катализаторов. [16]
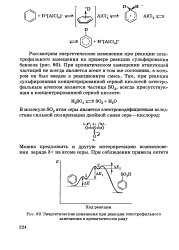 |
Энергетические изменения при реакции электрофильного замещения в ароматическом ряду. [17] |
При ароматическом замещении атакующей частицей не всегда является агент в том же состоянии, в котором он был введен в реакционную смесь. [18]
 |
Относительные скорости реакций и выход изомеров при нитровании толуола. [19] |
Для теории ароматического замещения эта концепция является совершенно новой. Подтверждением этой точки зрения является корреляция скоростей реакций нитрования со стабильностью я-комплексов. Если рассматривать стабильность я-комплекса как критерий донорной способности, то в реакции с нитронием можно принять, что я-электронная плотность алкилбензолов мало зависит от алкильных групп и не очень чувствительна к замещающим агентам. Отсюда понятна низкая селективность по отношению к субстрату. Считают, что я-комплексы, в которых электрофильный агент находится вблизи положений с наибольшей электронной плотностью, способны вызывать определенную ориентацию в ходе реакции; поэтому переход от внешнего к внутреннему комплексу приводит к нормальной ориентации. Но, как отметил Ола, парциальные факторы скоростей реакций, факторы селективности и соотношение селективности в целом могут иметь смысл только в тех реакциях, где при образовании а-комплекса индивидуальные положения участвуют в реакции с электрофильным агентом, а не в тех, где сначала вся молекула вступает в реакцию, а уже потом - в индивидуальные положения. [20]
Применение электрофилыюго ароматического замещения с помощью карбонильных соединений ограничено: ароматические ядра с еильнодезактивирующими заместителями ( - NOs, - COR, - CN) не реагируют вообще, если только действие этих групп не компенсируется дополнительными окси -, алкил -, амиио - и другими группами. [21]
В реакциях ароматического замещения не обязательно проявляются кинетические изотопные эффекты. Например, нитробензол нитруется с той же скоростью, что и его пентадейтерированный аналог, тогда как реакция азосочетания с фенолом после дейтерирования замедляется в 7 раз. [22]
Третий тип ароматического замещения - при действии ну-клеофильных агентов - не был исследован количественно в случае незамещенных углеводородов. Примером такой реакции служит аминирование нафталина амидом натрия по Чичиба-бину. Примеры обоих типов будут рассмотрены в гл. [23]
Для реакций ароматического замещения, которые осуществляются под действием положительных или отрицательных ионов, наибольшее значение будет иметь распределение электронной плотности в молекуле. [24]
В случае ароматического замещения вероятность события определяется долей соответствующего изомера. [25]
В кинетике ароматических замещений тоже встречаются случаи, когда бимолекулярная реакция фактически оказывается только квазибимолекулярной. Как метод, в этом отношении заслуживает внимания исследование изотопного эффекта. В реакции нитрования изотопного эффекта по было обнаружено, что не доканывает, конечно, ничего другого, кроме того, что участие протон-акцептора не лимитирует общей скорости нитрования. [26]
Из реакций ароматического замещения наиболее тесно связана с проблемой карбониевых ионов реакция электрофильного изотопного обмена водорода. [27]
Другие реакции ароматического замещения, помимо ацилирования и а лкилирования, известны лишь для С5Н5М ( СО) 3, где М Mn, Re. Наибольшее число реакций осуществлено для ЦТМ. В этом отношении химия ЦТМ может быть сравнена с химией ферроцена. [28]
Исследования по ароматическому замещению, проведенные на ди-циклопентадиенильных производных рутения и осмия, показывают, что реакционная способность прогрессивно уменьшается с увеличением атомной массы металла, вероятно, из-за увеличения прочности связей кольцо - металл. Трикарбонилциклопентадиенилмагний претерпевает ацилирование и алкилирование по Фриделю-Крафтсу и по своей реакционной способности занимает промежуточное положение между анизолом и бензолом и, следовательно, значительно уступает в этом отношении ферроцену. [29]
Имидазолы подвергаются типичному ароматическому замещению. Они могут галоидироваться, сульфироваться, нитроваться и сочетаться с диазотированными ароматическими аминами, образуя азосоединения; однако они не могут нитрозироваться азотистой кислотой. [30]
Страницы: 1 2 3 4