Валентность - марганец
Cтраница 2
 |
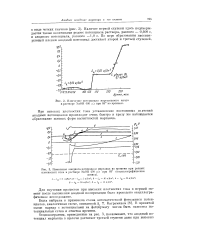
Поляризационные кривые при анодном растворении марганца в щелочи. [ NaOH ] 400 г / л. [16] |
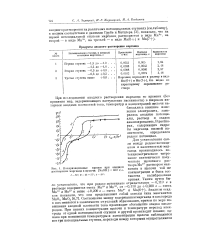
Для установления связи между редокс потенциалом и валентностью марганца производилось по-тенциометрическое титрование синтетически полученного щелочного раствора Мп2 раствором ман-ганата в щелочи той же концентрации и была составлена калибровочная кривая. Соотношение между содержанием марганца и кислорода в них меняется в зависимости от условий образования, причем по мере повышения анодной плотности тока происходит обогащение осадка кислородом. [17]
Здесь катализатор образует промежуточное соединение МпО с иной валентностью марганца. [18]
На основании сказанного можно сделать следующий вывод: с увеличением валентности марганца наблюдается постепенный переход от основных соединений к кислотам. [19]
Таким образом, можно сделать вывод, что с повышением валентности марганца свойства оксидов и гидроксидов изменяются от основных к кислотным. [20]
Однако для правильного суждения о природе продуктов окисления необходимо точно знать валентность марганца. [21]
Тот факт, что раствор манганата ( соли марганцовистой кислоты), в котором валентность марганца равна шести, легко разлагается, указывает только, что свободная энергия а системе, состоящей из четырех - и семивалентного марганца, меньше свободной энергии, заключающейся в системе, содержащей весь марганец в шестивалеитной форме. Часто условия бывают как раз обратные, и наиболее устойчивым состоянием является состояние промежуточной валентности. Так, перманганат и соль двухвалентного марганца реагируют, образуя четырехвалентный марганец. [22]
Тот факт, что раствор манганата ( соли марганцовистой кислоты), в котором валентность марганца равна шести, легко разлагается, указывает только, что свободная энергия а системе, состоящей из четырех - и сем И-валентного марганца, меньше свободной энергии, заключающейся в системе, содержащей весь марганец в шестивалеитной форме. Часто условия бывают как раз обратные, и наиболее устойчивым состоянием является состояние промежуточной валентности. Так, перманганат и соль двухвалентного марганца реагируют, образуя четырехвалентный марганец. [23]
Так, широко применяемая реакция окисления оксалатов перманганатом калия протекает в несколько стадий с постепенным изменением валентности марганца. Получившиеся промежуточные продукты могут взаимодействовать между собой или с основным веществом. Например, возможно окисление образовавшихся ионов двухвалентного марганца перманганатом до ионов четырехвалентного марганца, который также является окислителем и участвует в реакции. [24]
MnIV - Mn, то обратимость реакции ( 2) означает, что селенистая кислота способствует изменению валентности марганца и в обратном направлении, что особенно четко проявляется еще в одной найденной нами реакции, описанной далее. [25]
Что действительно молекула КМпО4 получает при реакции 5 электронов, легко заключить также из того факта, что валентность марганца понижается при реакции с 7 ( в КМпО4) до 2 ( в MnSO4), а уменьшение положительной валентности на единицу происходит, очевидно, при присоединении одного электрона. [26]
Что действительно молекула КМпО4 получает при реакции 5 электронов, легко заключить также из того факта, что валентность марганца понижается при реакции с 7 ( в К. [27]
Что действительно молекула КМпО4 получает при реакции 5 электронов, легко заключить также из того факта, что валентность марганца понижается при реакции с 7 ( в КМпО4) до - 4 - 2 ( в MnSO4), а уменьшение положительной валентности на единицу происходит, очевидно, при присоединении одного электрона. [28]
Считают, что роль марганцевого катализатора окисления заключается в инициировании радикально-цепных реакций в начальной стадии окисления за счет изменения валентности марганца от 2 до 3 и 4 и от 4 до 3 и 2, а также в регулировании процессов окислительных превращений промежуточных продуктов преимущественно в кислоты и эфиры. [29]
Страницы: 1 2 3