Координационная валентность
Cтраница 3
Вернеровскую главную валентность теперь мы понимаем как электровалентность, служащую причиной присоединения или отдачи электронов с внешней электронной оболочки атома или иона. Побочная валентность есть координационная валентность; электроны отдаются центральному атому молекулой или ионом, входящим в комплекс. Электроны отдаются парами, и двумя, четырьмя, шестью и даже восемью парами переходят к центральному атому. Координационное число, таким образом, является числом пар электронов, использованных при образовании комплекса. [31]
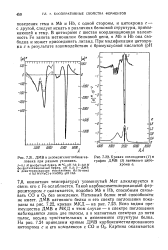 |
Кривая поглощения ( 1 и график ДМВ ( 2 нативного цитохрома с. [32] |
НЬ, с одной стороны, и цитохрома с - с другой, следует искать в различиях белковой структуры, примыкающей к тему. В цитохроме с шестая координационная валентность Fe занята метионилом белковой цепи, в Mb и НЬ она свободна и может присоединять лиганд. [33]
Наиболее ценным свойством жомплексонов является их способность давать внутрикомплексные соли с ионами щелочноземельных металлов, ионами редкоземельных элементов и др., так как эти катионы трудно или невозможно перевести в комплексы другими средствами. При ( этом сразу насыщаются основные и координационные валентности данного металла. [34]
Особую группу составляют сверхкомплексные соединения. В них число лиган-дов превышает координационную валентность комплексообразователя. У меди координационная валентность равна четырем и во внутренней сфере координированы четыре молекулы воды. Пятая молекула присоединяется к комплексу при помощи водородных связей. [35]
Особую группу составляют сверхкомплексные соединения. В них число лиган-дов превышает координационную валентность комплексообразователя. Примером может служить CuSO - SHjO. У меди координационная валентность равна четырем и во внутренней сфере координированы четыре молекулы воды. Пятая молекула присоединяется к комплексу при помощи водородных связей. [36]
Величина ионной электропроводности большинства ионов, за исключением ионов водорода и гидроксила, а также ионов с длинной цепью, составляет около 60 омг - см при 25; это обстоятельство может быть использовано для выяснения характера диссоциации электролитов. При изучении комплексных соединений с координационной валентностью очень важно уметь определять, является ли-связь атома галоида или другой отрицательной группы с ком-плексообразователем ковалентной или электровалентной. [37]
Особую группу составляют сверхкомплексные соединения. В сверхкомплексных соединениях число лигандов превышает координационную валентность комплексообразователя. У меди координационная валентность равна 4 и во внутренней сфере координировано четыре молекулы воды. Пятая молекула воды присоединяется к комплексу при помощи водородных связей. [38]
В теме четыре лигандные группы плоского порфиринового кольца ( см. рис. 17) образуют комплекс с ионом железа, находящемся в центре кольца. В образовании этого комплекса участвуют четыре из шести координационных валентностей иона железа. Оставшиеся две валентности иона железа расположены перпендикулярно плоскости кольца. В миоглобине и гемоглобине одна из валентностей используется для образования связи с гистидиновым остатком белковой цепи, а шестая участвует в присоединении молекул кислорода. [39]
Ванденберг предполагает, что дополнительная роль координационного хелатирующего агента может сводиться к замедлению обычной кислотной или катионной полимеризации в результате блокирования четвертой координационной валентности алюминия. Благодаря этому в акте координационного роста цепи могут участвовать только пятая или пятая и шестая координационные валентности алюминия. Блокирование четвертой координационной валентности представляется существенно важным фактором, препятствующим реакции обрыва цепи, что приводит к получению полимеров исключительно высокого молекулярного веса. [40]
Используя указанные различия в растворимости твердого роданида железа в растворителях указанных двух классов, можно открывать кислород в органических соединениях. По-видимому, молекулы кислородсодержащих растворителей способны образовывать устойчивые сольваты с молекулами роданида железа при помощи координационной валентности их кислородных атомов. У молекул жидких углеводородов и их га г огензамещенных эти координационно-активные атомы отсутствуют, и поэтому они не образуют сольватов с солью железа. Зто предположение подтверждается тем фактом, что жидкие углеводороды и их галогензамещенные приобретают способность растворять роданид железа только в том случае, если в них растворены или к ним прибавлены кислородсодержащие соединения. По существу, это явление аналогично процессу образования сольватов, протекающему при растворении иода в органических растворителях и сопровождающемуся возникновением бурого окрашивания. [41]
Однако, если получающиеся комплексы значительны по своим размерам, а Жмюгенмые группы смолы блокируют часть координационной валентности металла, то максимальная лигандообменная емкость может е достигаться. [42]
Данные ИК-спектроскопии позволяют сделать довольно однозначный вывод о строении рассмотренных комплексов Be со смешанными лиган-дами. Эти данные предполагают наличие в них молекулярных решеток, образованных изолированными группировками с атомом Be в центре, причем координационные валентности бериллия насыщены за счет связей с двумя монодентатными кислотными остатками и двумя атомами азота аммиака или жирного амина. В работах [13-15] рассматриваются также другие возможные с точки зрения формульного состава структурные варианты. Ни один из них, однако, не удается положить в основу интерпретации наблюдаемого спектра. [43]
Ассоциация каталитических центров, обусловленная координационной ненасыщенностью цинка, является отрицательным фактором в полимеризации. Ишимори и Тзурута 14в полагают, что в росте цепи могут участвовать только периферические центры крупных ассоциа-тов, у которых имеются свободные координационные валентности. Высокая активность диалкоксидов in situ обусловлена как раз тем, что число таких центров велико. [44]
Существует другая группа молекул и молекулярных комплексов f которая, по-видимому, имеет важное значение в области полимеризации с контролируемым ростом цепи, а именно комбинации талогенидов металлов с гидридами металлов или металлалкилами, типичные для большинства катализаторов Циглера. Хорошо известно, что трехфтористый бор, а также триметилбор обладают сильно выраженной тенденцией к заполнению своего электронного октета и проявлению координационной валентности, равной четырем, посредством комплексообразования с донорами электронных пар, например водой или аммиаком. В этом случае неноделенная электронная пара воды или аммиака заполняет координационную сферу атома бора. [45]
Страницы: 1 2 3 4