Высшая положительная валентность
Cтраница 1
Высшая положительная валентность у них равна 5, соответственно номеру группы. Атом азота не может иметь во внешнем слое более трех неспаренных электронов ( стр. [1]
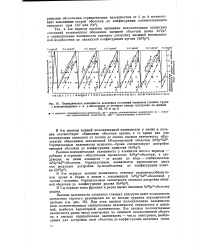 |
Периодическая зависимость валентных состояний элементов главных групп с заполняющимися s - и р-оболочками от атомного номера ( построено по данным. [2] |
Высшая положительная валентность у элементов пятого периода - рубидия и стронция - обусловлена прочностью 4з24рв - оболочки, а следующих за ними элементов - от индия до иода - стабильностью 4524рв4210 - оболочки. [3]
Высшая положительная валентность у них равна 5, соответственно номеру группы. Атом азота не может иметь во внешнем слое более трех неспаренных электронов ( стр. [4]
Высшая положительная валентность марганца равна семи, и и марганец в таблице Менделеева помещен в VII группу. [5]
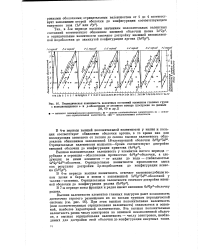 |
Периодическая зависимость валентных состояний элементов главных групп с заполняющимися s - и р-оболочками от атомного номера ( построено по данным. [6] |
При этом высшая положительная валентность или соответствующая отрицательная валентность) оказывается и основной, наиболее характерной валентностью. Эта высшая положительная валентность равна числу электронов во внешней незаполненной оболочке, а высшая отрицательная валентность - числу электронов, необходимых для достройки этой оболочки до конфигурации инертных газов. [7]
Чему равняется их высшая положительная валентность. [8]
Элементы подгрупп имеют высшую положительную валентность в соответствии с номером группы, но по другим свойствам они значительно отличаются от элементов основных групп. В подгруппах, образованных нечетными рядами ( как в подгруппах меди и цинка), элементы - менее металличны, а в подгруппах, образованных четными рядами ( в подгруппах скандия, титана, ванадия, хрома и марганца) - более металличны по сравнению с элементами соответствующих основных групп. [9]
Поэтому, зная высшую положительную валентность металлоида, легко найти его отрицательную валентность и наоборот. [10]
У элементов главных подгрупп высшая положительная валентность определяется общим числом ns - и np - электронов внешнего слоя атома. У элементов же побочных подгрупп суммируются ns - и и ( п - 1) с ( - электроны внешнего ( п) и предвнешнего ( п - 1) электронных слоев. Эти суммы и отвечают номеру группы. [11]
Положительно заряженные ионы, проявляющие высшие положительные валентности, являются окислителями, так как они потеряли все валентные электроны и поэтому могут только принимать электроны. [12]
Все элементы Ilia подгруппы имеют высшую положительную валентность 3) соответствующую номеру группы. Устойчивость их одновалентных состояний указывает на известную стабильность внешней s2 - конфигурации и легкое отделение одного внешнего р-электрона. [13]
Сера в соединении со фтором проявляет высшую положительную валентность. [14]
В этом случае валентность азота 5 называют его высшей положительной валентностью. Остальные валентности азота являются низшими. [15]
Страницы: 1 2 3 4