Принцип - подвижное равновесие
Cтраница 1
Принцип подвижного равновесия позволил определять направление реакций при равновесиях, дал возможность глубже понять природу различных веществ, связывая их свойства с теми процессами, при которых они образуются. На основе изучения химического равновесия впервые было обращено большое внимание на зависимость хода и результата реакций от влияния таких факторов, как химическая масса, природа растворителя, температура, давление, и других внешних условий. [1]
Согласно принципу подвижного равновесия Ле-Ша - тельс, система, находящаяся в равновесии, реагирует на любое внешнее воздействие так, чтобы уменьшить это воздействие. [2]
Как формулируется принцип подвижного равновесия Ле-Шателье. [3]
Рассмотрим содержание принципа подвижного равновесия на примерах. [4]
На основании принципа подвижного равновесия увеличение концентрации [ FeO ] в жидком металле должно способствовать смещению равновесия реакции справа налево. Это тормозит растворение водорода в сварочной ванне и уменьшает опасность образования пористости от водорода при недостаточно прокаленном флюсе или при сварке по ржавчине. [5]
Это согласуется с принципом подвижного равновесия, по которому для обратимых реакций в газовой фазе при увеличении давления равновесие смещается в сторону образования меньшего числа молекул, и наоборот. [6]
ЛЕ ШАТЕЛЬЕ ПРИНЦИП ( принцип подвижного равновесия) - правило, характеризующее влияние изменения условий на состояние равновесия, сформулировал ле Шателье в 1884 г.: Если на систему, находящуюся в равновесии, воздействовать извне, изменяя какое-нибудь из условий ( температуру, давление, концентрацию), то раьновесие смещается в том направлении, при котором изменение от внешнего воздействия уменьшается. Иначе говоря, повышение температуры вызывает смещение равновесия в сторону образования продуктов с поглощением теплоты, повышение давления смещает равновесие в сторону процесса, происходящего с уменьшением объема. Увеличение концентрации одного из компонентов, принимающих участие в реакции, приводит к изменению равновесия в направлении процесса, сопровождающегося уменьшением концентрации этого компонента. [7]
Кроме того, согласно принципу подвижного равновесия при охлаждении равновесной системы в ней должны развиваться экзотермические реакции. [8]
Это положение известно под названием принципа подвижного равновесия л е - Ш ате лье - Браун а - Вант-Гоффа и пользуется большим распространением в технике, давая простой и наглядный суррогат второго начала, несколько сложного для незнакомых с термодинамикой. Будучи очень полезным для качественной ориентировки, он не дает однако количественных выводов и вполне покрывается знакомыми нам выводами из второго начала в виде уравнения изотермы или изобары реакции и уравнения К л апейрона - Кл ауз иуса. [9]
Полученный вывод в количественной форме подтверждает принцип подвижного равновесия, впервые выдвинутый Ле Шателье. Этот принцип может быть сформулирован следующим образом. [10]
Это правило называется принципом Ле Шателье или принципом подвижного равновесия. [11]
Как и все обратимые процессы, адсорбция подчиняется принципу подвижного равновесия. Так, повышение температуры сдвигает равновесие в сторону эндотермического процесса. С повышением давления, как правило, увеличивается количество адсорбированного газа. [12]
 |
Диаграмма состояния системы вода - никотин. [13] |
Существование верхней и нижней критических температур растворимости объясняется при помощи принципа подвижного равновесия Ле-Шателье - Брауна. Если, наоборот, растворение сопровождается выделением теплоты, то это приводит к появлению нижней критической температуры растворимости. Если при изменении температуры теплота раствсфения меняет знак, то это приводит к появлению верхней и нижнеД критических, температур растворимости. [14]
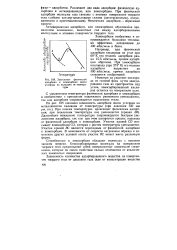 |
Зависимост физической адсорбции и хемосорбции окиси углерода на палладии от температуры. [15] |
Страницы: 1 2 3 4