Принцип - соответственное состояние
Cтраница 3
Исходя из принципа соответственных состояний, для всех газов однозначными функциями приведенных давлений и температур ( п и т) являются следующие. [31]
Классический вывод принципа соответственных состояний исходит из утверждения, что имеется уравнение состояния с двумя коэффициентами, применимое для всех веществ. [32]
При использовании принципа соответственных состояний для смеси необходимо определить критические параметры гипотетического чистого вещества, эквивалентного смеси. Такие псевдокритические параметры весьма существенно отличаются от истинных критических параметров смеси. [33]
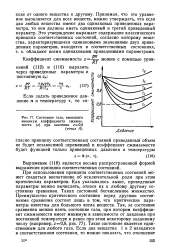 |
Состояние газа, имеющего. [34] |
При использовании принципа соответственных состояний может создаться впечатление об исключительной роли при этом критических параметров. [35]
Основанный на принципе соответственных состояний обобщенный метод расчета р - V - Г - свойств индивидуальных газов может быть применен и к вычислению свойств газовых смесей. Эти усредненные критические параметры называются пссвдокритическпми. [36]
Основанный на принципе соответственных состояний обобщенный метод расчета р - V - У-свойств индивидуальных газов может быть применен и к вычислению свойств газовых смесей. Поэтому при расчете свойств смесей применяются такие специально подобранные значения исправленных критических параметров, при использовании которых могут применяться те же соотношения, что и для индивидуальных газов. Эти усредненные критические параметры называются псевдокритическими. [37]
Основанный на принципе соответственных состояний обобщенный метод расчета термодинамических свойств индивидуальных газов может быть применен и к вычислению свойств газовых смесей. Важным положительным фактором является то обстоятельство, что при определении свойств газовых смесей можно использовать такие параметры, как коэффициент сжимаемости, остаточный объем или соответственно уравнение состояния в приведенной форме, сохранив неизменной обобщенную методику, разработанную для чистых газов. Однако опыт показывает, что использование истинных критических параметров смесей приводит к значительным отклонениям кривых, выражающих свойства газовых смесей, от кривых, представляющих свойства чистых газов. Эти усредненные критические параметры называются псевдокритическими. [38]
Как известно, принцип соответственных состояний и вытекающие из него многочисленные следствия ( см., например, [73]) приводят лишь к весьма приближенным результатам. [39]
Несмотря на это принцип соответственных состояний в его классической форме широко применяется для нахождения объемных свойств газов. Зависимость коэффициента сжимаемости от приведенных давления и температуры - см. ( 118) приводится во многих справочниках и руководствах. [40]
Предложенный новый вариант принципа соответственных состояний распространен на полярные вещества. При использовании обобщенных зависимостей в случае полярных веществ к фактору корреляции р вводится поправка, зависящая от безразмерного дипольного момента молекул. Это позволяет существенно уменьшить ошибки при расчетах термодинамических свойств. [41]
Согласно классической форме принципов соответственных состояний (2.4) зависимость приведенного давления пара от приведенной температуры является универсальной. Приведенное давление пара вещества с частицами, отклоняющимися от шаровой симметрии, отличается от приведенного давления пара, полученного при той же температуре по универсальной зависимости. Питцером было предложено в качестве третьего параметра использовать величину этого отклонения, названного ацентрическим фактором. Ацентрический фактор призван учесть отклонение от шарообразной формы строения молекул вещества. [42]
Классический путь вывода принципа соответственных состояний для чистого вещества основан на анализе двупараметриче-ского уравнения состояния чистого вещества. Из этого уравнения может быть получено уравнение состояния в приведенной форме, которое является выражением принципа соответственных состояний. Аналогичный путь вывода принципа соответственных состояний возможен и для смесей. При этом исходят из уравнения состояния смесей. Опыт свидетельствует о том, что во многих случаях уравнения состояния для смесей имеют тот же вид, что и для чистых веществ. [43]
Двухпараметрическая классическая форма принципа соответственных состояний, рассмотренная выше при описании уравнения состояния Ван-дер - Ваальса, справедлива лишь для молекул, обладающих шаровой симметрией, не имеющих дипольных моментов и не проявляющих квантовых эффектов, т.е. для неполярных веществ. В остальных случаях необходимо введение дополнительных безразмерных параметров. В качестве третьего параметра Питцером был введен так называемый ацентрический фактор, величина которого определяется исходя из зависимости приведенного давления пара от приведенной температуры. [44]
Этот закон называется принципом соответственных состояний. Он лежит в основе теории термодинамического подобия. [45]
Страницы: 1 2 3 4