Природа - электрофил
Cтраница 1
Природа электрофила, несомненно, изменяется в зависимости от природы используемого реагента, хотя во всех случаях участвует серный ангидрид в свободном состоянии или связанный с носителем таким как серная кислота или ион гидроксония. [1]
Природа электрофила в большинстве случаев точно неизвестна. Предполагают, что в реакции с пероксидом водорода электрофи-лом является ион иодноватистой кислоты. Имеются указания, что в случае перуксусной кислоты электрофил представляет собой аце-тилгипоиодит или его протонированную форму. Последняя система перспективна как удобный препаративный метод иодирования, не только потому, что реакция проходит быстрее, чем при обычных методах, но и потому, что более жесткие пространственные требования делают реакцию более селективной. Так, иодирование аценаф-тена дает 5-иодаценафтен, а флуорена ( уравнение 152) - 2-иод-флуорен с выходом 40 и 65 % соответственно. [2]
Это непосредственно приводит к рассмотрению природы действующего электрофила и ее влияния на присоединение. Теоретически любой электрофил С1Х может либо сам атаковать олефин, либо сначала диссоциировать, давая более эффективный электрофил С1, сольва-тированный или несольватированный. [3]
Исследование зависимости особенностей присоединения к нор-борненам от природы электрофила выходит за рамки поставленной здесь задачи. [4]
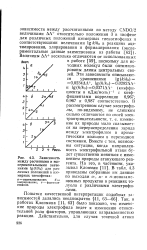 |
Зависимость между расчетными и экспериментальными значениями Ig ( k / k0 для различных положений в изомерных тиенофенах. а - а цетилярованне. б - хлорирование. в - формили-рование. [5] |
Так, в работах Клопмана [11, 63] было показано, что изменение природы электрофила ведет к изменению относительной роли факторов, упра1вляющих направленностью реакции. [6]
Имеющиеся в настоящее время кинетические данные не позволяй сделать однозначный вывод о природе реагирующего электрофила. Большинство обсуждений механизма основано на данных по скоростям конкурирующих реакция и влиянию структуры на реакционную способность. [7]
Таким образом, можно ожидать, что эти реакции будут очень чувствительны к природе электрофила и условиям фосфорилирования. [8]
Реакция образующегося стабилизованного бором аллильного аниона с электрофилами может идти по двум положениям; какое из них предпочтительно, определяется в основном природой электрофила. Вода и метилиодид атакуют а-положе-ние, в результате чего получаются аллильные производные бора, в то время как Me3SiCl и ацетон атакуют главным образом у-положение. [9]
Реакция образующегося стабилизованного бором аллильного аниона с электрофилами может идти по двум положениям; какое из них предпочтительно, определяется в основном природой электрофила. Вода и метилиодид атакуют - положение, в результате чего получаются аллильные производные бора, в то время как Me3SiCl и ацетон атакуют главным образом у-положение. [10]
Этот ряд, однако, является условным, поскольку он изменяется при переходе от одного процесса замещения к другому и зависит в определенной степени от природы атакующего электрофила. [11]
По мнению Трейлера [301], электрофильное присоединение к напряженным бициклоолефинам протекает в основном по двум механизмам - с промежуточным образованием неклассических ионов и цис-сш-хронным путем; соотношение этих процессов определяется природой электрофила и строением олефина. [12]
В соответствии с этим индолил-анион вступает в ре-в качестве амбидентного нуклеофила; соотношение реакций N - и р-замещения при взаимодействии с электрофилами зависит от природы ассоциированного металла, полярности растворителя и природы электрофила. Наиболее реакционноспособные электрофилы проявляют ббльшую тенденцию атаковать атом азота, чем менее электрофильные частицы. [13]
Если бы все реакции электрофильного присоединения хлора проходили через классический ион карбония, который образуется прямо из электрофила и олефина и в котором были бы неважны взаимодействия между карбониевым центром и связанным заместителем, то нельзя было бы ожидать, что продукты сильно зависят от природы электрофила, начинающего атаку. Данные об ионах карбония, полученных другими путями ( гл. В действительности следует ожидать, что осложнения реакционного процесса, связанные с участием нескольких последовательных промежуточных соединений [ уравнение ( 6 - 10) ], будут проявляться в изменении природы продуктов. Что касается ориентации продуктов, то здесь изучено мало примеров, и результаты несколько противоречивы. Два возможных продукта присоединения хлорноватистой кислоты к хлористому аллилу [5] образуются в примерно равных количествах; следовательно, ведущие к ним переходные состояния не могут сильно отличаться по свободной энергии активации. Продукты реакции изучались в условиях, которые должны обусловливать инициирование реакции положительным галогеном, хлором и моноокисью хлора. [14]
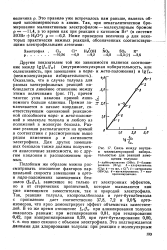 |
Связь между внутри-и межмолекулярной избирательностью для реакций замещения толуола. [15] |
Страницы: 1 2 3