Viiia-группа
Cтраница 3
Однако валентные электроны расположены на разных подуровнях, как это мы увидим далее, что и создает специфические свойства элементов. VIIIB-rpynna расположена в центре таблицы, а VIIIA-группа ( или нулевая группа, как ее определил Д. И. Менделеев) естественным образом замыкает периоды. [31]
 |
Алхимические символы. [32] |
К 1900 г. уже значительная часть химиков считала, что не атомная масса, а порядковый номер элемента ( или заряд ядра его атомов) является основой для периодической классификации. Вместе с другими благородными газами аргон располагается в VIIIA-группе. [33]
В каждой из А-групп р-элементов наблюдается усиление сверху вниз металлических свойств, причем с увеличением номера группы число элементов-неметаллов в группе возрастает. Если в ША-группе неметаллом является только бор, то в VIIIA-группе все элементы ( благородные газы) принадлежат к неметаллам. Необходимо отметить, что все неметаллы находятся среди р-элементов. [34]
Таким образом, инертность этих элементов, обусловленная необычайной устойчивостью электронного октета, и нулевая валентность их ( кроме гелия и неона) оказались иллюзорными. Так как для этих газов известны соединения с валентностью 8, они должны быть включены в VIIIA-группу периодической системы на правах полноправных элементов, обретших свою химическую индивидуальность. [35]
Оказалось, что в своих соединениях с кислородом и фтором ксенон проявляет максимальную степень окисления 8 ( ХеО4 и XeF8) и по праву может считаться представителем VIIIA-группы. [36]
Все периоды системы завершаются элементами VIIIA-группы. С точки зрения электронного строения неон и тяжелые благородные газы естественно поместить в VIIIA-группу, поскольку на внешней оболочке они содержат 8 электронов и являются s / j - элементами. Гелий с этой точки зрения относится к s - элементам ( как и водород) и формально должен возглавлять ПА-группу. [37]
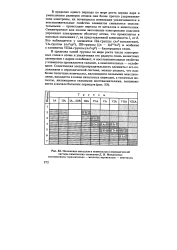 |
Положение металлов и неметаллов в периодической. [38] |
В пределах одного периода по мере роста заряда ядра и уменьшения размеров атомов они более прочно удерживают свои электроны, их потенциалы ионизации увеличиваются и восстановительные свойства элементов сменяются окислительными - происходит переход от металлов к неметаллам. Симметричное или полное заполнение электронами подслоев упрочняет электронную оболочку атома, что проявляется в пиковых значениях 1г на представленной зависимости 1г от Z. Это наблюдается у элементов ПА-группы ( гав2 - заполнение), VA-группы ( ns2np3), ПВ-группы [ ( п - I) d10res2 ] и особенно у элементов VIIIA-группы ( ns2npe) - благородных газов. [39]
Вместе с тем низкие значения термических и термодинамических характеристик фазовых переходов указывают на слабость межмолекулярных сил. Особенно это касается инертных газов - гелия и неона. В этом направлении увеличиваются плотность и растворимость в воде. Поскольку межмолекулярные силы ненаправлены и ненасыщены, все элементы VIIIA-группы в твердом состоянии образуют плотноупакованные структуры. [40]
По этой причине его и помещают вместе с представителями VIIIA-rpyn - пы. Особенности электронной конфигурации неона ( Is22s22pe и отсутствие вакантной d - оболочки при п2) также предопределяют его химическую инертность. Дело в том, что промотирование электрона с изменением главного квантового числа ( для Не Is - - 2s, для Ne 2p - - 3s) требует такой высокой энергии, которая не может быть компенсирована энергией химической связи при образовании соединений. Поэтому они в принципе способны образовывать валентно-химические соединения за счет распаривания электронов. Принимая во внимание эти различия в эледтронном строении, гелий и неон целесообразно называть инертными газами, а аргон и более тяжелые газы VIIIA-группы - благородными. [41]
Так, хорошо известна неопределенность положения водорода. С другой стороны, хотя 14 актиноидов по аналогии с лантаноидами находятся в одной клетке с актинием, это их положение не вполне отвечает их химическим свойствам. Известно, что первые представители актиноидов - Th, Pa, U - часто проявляют степени окисления 4, 5, 6 соответственно. Именно на этом основании еще Д. И. Менделеев поместил эти элементы в IV, V и VI группы системы. Таким образом, можно отметить, ЧТОБ принятой в настоящее время форме периодической системы не соблюдается последовательно принцип химической аналогии. Помещение же этих элементов в VIIА - и VIIIA-группы ( среди р-элементов) с учетом свойств простых веществ неоправдано. [42]
Все периоды системы завершаются элементами УША-группы. С точки зрения электронного строения, неон и тяжелые благородные газы естественно поместить в УША-груп-пу, поскольку на внешней оболочке они содержат восемь электронов и являются, sp - элементами. Гелий с этой точки зрения относится к - элементам ( как и водород) и формально должен возглавлять ПА-группу. Однако у атома гелия отсутствует возможность промотирования электрона, что и определяет его химическую инертность. По этой причине его и помещают вместе с представителями VIIIA-группы. Особенности электронной конфигурации неона ( Is22s22p6 и отсутствие вакантной rf - оболочки при п 2) также предопределяют его химическую инертность. Дело в том, что промотирование электрона с изменением главного квантового числа ( для Не Is - - 4 2s, для Ne 2p - 3s) требует такой высокой энергии, которая не может быть компенсирована энергией химической связи при образовании соединения: Кроме того, орбитали Is ( Не) и 2р ( Ne) кайносимметричны, что является еще одной причиной инертности этих элементов. Поэтому они в принципе способны образовывать валентно-химические соединения за счет распаривания электронов. Принимая во внимание эти различия в электронном строении, гелий и неон целесообразно назвать инертными газами, а аргон и более тяжелые газы УША-группы - благородными. [43]
Все периоды системы завершаются элементами VHIA-группы. С точки зрения электронного строения, неон и тяжелые благородные газы естественно поместить в VIIIA-rpyn - пу, поскольку на внешней оболочке они содержат восемь электронов и являются sp - элементами. Гелий с этой точки зрения относится к s - элементам ( как и водород) и формально должен возглавлять ИА-группу. Однако у атома гелия отсутствует возможность промотирования электрона, что и определяет его химическую инертность. По этой причине его и помещают вместе с представителями VHIA-группы. Особенности электронной конфигурации неона ( Is22s22p6 и отсутствие вакантной rf - оболочки при п - 1) также предопределяют его химическую инертность. Дело в том, что промотирование электрона с изменением главного квантового числа ( для Не Is - 2s, для Ne 2p - 3s) требует такой высокой энергии, которая не может быть компенсирована энергией химической связи при образовании соединения. Кроме того, орбитали Is ( Не) и 2р ( Ne) кайносимметричны, что является еще одной причиной инертности этих элементов. Поэтому они в принципе способны образовывать валентно-химические соединения за счет распаривания электронов. Принимая во внимание эти различия в электронном строении, гелий и неон целесообразно назвать инертными газами, а аргон и более тяжелые газы VIIIA-группы - благородными. [44]
Страницы: 1 2 3