Денатурирующий агент
Cтраница 1
Денатурирующие агенты делятся на химические и физические. К последним относится прежде всего температурное воздействие, в частности замораживание или нагревание, а также давление, ультразвуковое воздействие, облучение и др. Химические агенты - это органические растворители ( ацетон, хлороформ, спирт), концентрированные кислоты, щелочи, ионы тяжелых металлов. В лабораторной практике в качестве денатурирующих агентов чаще всего используют мочевину или гуанидинхлорид, легко разрывающие водородные и гидрофобные связи, при помощи которых формируется третичная структура белка. [1]
Денатурирующие агенты очень различаются по своему действию, главным образом в зависимости от свойств тех белков, на которые они действуют. Некоторые белки ( например, волосы и кожа) очень устойчивы ко многим денатурирующим агентам. Следует заметить, что белки волос, шерсти, перьев, когтей, копыт и в меньшей степени белки кожи животных и человека богаты ди-сульфидными связями, которые обеспечивают высокую прочность их вторичной структуры. [2]
Разные денатурирующие агенты вызывают различное изменение конформации. Один и тот же белок может вступать в различные реакции денатурации. Денатурация сывороточного альбумина происходит также под действием тепла32, приводя к получению продукта, нерастворимого в определенных стандартных условиях, при которых нативный продукт растворим. Вопрос о том, является ли конформация макромолекул на начальных стадиях процесса более развернутой, не исследовался. [3]
Если денатурирующий агент удалить из среды или приостановить денатурацию каким-либо другим путем, то может произойти восстановление нативных свойств белка. [4]
Если убрать денатурирующий агент, то возможно восстановление слабых связей, а следовательно, олигомерного белка и его функций. [5]
Известны различные денатурирующие агенты. Высококонцентрированные гуанидингидрохлорид и мочевина используются для денатурации белков чаще всего. Экспериментальные данные свидетельствуют о том, что гуанидингидрохлорид с восстанавливающим агентом ( используемым для разрыва дисульфидных связей и предотвращения образования дисульфидных связей из SH-групп, освобождающихся при денатурации) является тем агентом, который следует использовать, если ставится задача достижения полной диссоциации молекул белка до составляющих их полипептидных цепей. [6]
Действие данного денатурирующего агента может быть связано либо с дестабилизацией нативного состояния, либо со стабилизацией денатурированного состояния, либо и с тем и с другим. Если исходить из данных по денатурации миоглоби-на, приняв этот белок в качестве модели, то можно сделать вывод, что большинство полярных групп как в нативном, так и в денатурированном состоянии обращено в сторону растворителя, тогда как полипептидная цепь и непо1 - лярные группы контактируют с растворителем только в денатурированном. [7]
Другим эффективным денатурирующим агентом является деионизованный формамид. [8]
Белки-ферменты чувствительны к денатурирующим агентам. [9]
Это значит, что такие денатурирующие агенты взаимодействуют в растворе с тетрапептидом, моделирующим амидные группы полипептидной цепи, понижая его энергию. [10]
Наибольший интерес представляет действие тех денатурирующих агентов, которые являются нейтральными и, на первый взгляд, индифферентными веществами. К числу таких веществ принадлежат мочевина, некоторые кислотные амиды и производные гуанидина. Мочевина не обладает ни кислыми, ни щелочными свойствами, не оказывает влияния на поверхностные явления и не вызывает токсического действия. Она, однако, является одним из немногих соединений, повышающих диэлектрическую постоянную воды. [11]
При гель-электрофорезе РНК в качестве денатурирующего агента обычно используют мочевину. [12]
Устойчивость нативной спиральной структуры к воздействию различных денатурирующих агентов на ДНК с различным нукяеотидным составом связана с содержанием в них ГЦ-пар нуклеотидов, а именно: о повышением содержания ГЦ-пар термостабильность ДНК ( устойчивость к денатурации нагреванием) возрастает линейно. [13]
Это вытекает из того, что влияние денатурирующего агента на стабильность полярных групп должно быть одинаковым как в нативном, так и в денатурированном состоянии, а полипептидная цепь и полярные группы в нативном состоянии изолированы от действия этого агента. Сравнительное изучение способности различных денатурирующих агентов переводить в растворимое состояние такие модельные соединения, как ацетилтетраглицин и карбобенз-оксидиглицинамид, позволяет высказать предположение, что действие этих агентов в значительной мере определяется их способностью стабилизировать пептидные связи и неполярные остатки. [14]
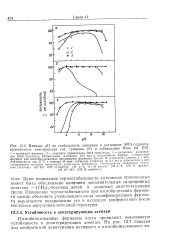 |
Влияние рН на стабильность анионных и катионных ЭМА-гидразид-производных химотрипсина ( а, трипсина ( б и субтилизина Ново ( б l J. [15] |
Страницы: 1 2 3 4