Потенциометрический анализ
Cтраница 2
В потенциометрическом анализе используют не абсолютные значения электродных потенциалов, а изменение потенциалов в ходе анализа, например при титровании. На этом и основан метод по-тенциометрического титрования. Непосредственный отсчет по значению электродного потенциала применяется для определения концентрации водородных ионов. [16]
При потенциометрическом анализе большое значение имеют процессы, в которых участвуют так называемые инертные электроды, например платиновый. [17]
В потенциометрическом анализе основными измерительными приборами являются потенциометры различных типов. Они предназначены для измерения ЭДС электродной системы. [18]
В потенциометрическом анализе важно правильно выбрать подходящий индикаторный электрод для определения точки эквивалентности. К этим электродам предъявляют некоторые специальные требования, рассмотренные в последующих параграфах. [19]
В потенциометрическом анализе различают метод прямой потенциометр ии и метод потенциометрического титрования. [20]
Для проведения потенциометрического анализа обычно собирают гальванический элемент, на одном из электродов которого протекает электрохимическая реакция с участием определяемого иона или иона, реагирующего с определяемым. При схематичном изображении различных гальванических элементов или электродов используют условную запись, достаточно полно отражающую состав и характерные особенности элемента. Форма и символика схематического изображения гальванических элементов установлены решением ИЮПАК. Двойная вертикальная черта показывает, что так называемый диффузионный потенциал, возникающий на поверхности раздела растворов разного состава, сведен к минимуму или элиминирован с помощью солевого мостика. [21]
 |
Стандартные буферные растворы. [22] |
Этот вид потенциометрического анализа широко используется в лабораторной практике. Он заключается в том, что точку эквивалентности при титровании определяют по резкому изменению разности потенциалов пары электродов, погруженных в анализируемый раствор. [23]
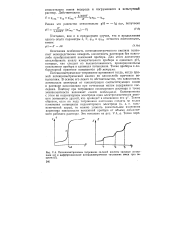 |
Потенциометрическое титрование сильной кислоты сильным основа - нием ( а и дифференциальное Потенциометрическое титрование смеси трех веществ ( б. [24] |
Описанная особенность потенциометрического анализа позволяет непосредственно измерять кислотность растворов без каких-либо преобразований показаний прибора. Для этого достаточно откалибровать шкалу измерительного прибора в единицах рН, которые, как следует из вышеизложенного, пропорциональны показаниям прибора в единицах потенциала. Такие приборы в лабораторной практике называются рН - метрами. [25]
Случайную погрешность потенциометрического анализа технологической среды, электропроводность которой изменяется во времени, можно свести к минимуму путем искусственного увеличения ее электропроводности. [26]
Торренс К - Потенциометрический анализ воды. [27]
Методика гидролиза, потенциометрический анализ проб реакционных растворов и расчет степени гидролиза аналогичны приведенным в работе 6.6. На основании полученных данных на одном графике строят кинетические кривые гидролиза полиакриламида и акриламида. [28]
 |
Типы каломельных полуэлементов. [29] |
В классическом методе потенциометрического анализа, как уже упоминалось выше, применяют два электрода: индикаторный электрод и электрод сравнения. [30]
Страницы: 1 2 3 4