Диэлектрическая проницаемость - растворитель
Cтраница 1
Диэлектрическая проницаемость растворителя в первом приближении является функцией величины обобщенного момента. Семенченко считает, что кривую, представленную на рис. 53, следует ожидать всегда и что первые два случая представляют неполную кривую. Полную кривую не всегда удается построить из-за экспериментальных трудностей. Растворимость таких полярных веществ, как соли, увеличивается с увеличением диэлектрической проницаемости. Максимума не наблюдается потому, что нет растворителя с такой высокой диэлектрической проницаемостью, при кото - 0 5 рой кривая прошла бы через максимум. При растворении неполярного вещества наблюдалась обратная картина-чем меньше диэлектрическая проницаемость, тем растворимость больше. [1]
Диэлектрическая проницаемость растворителя оказывает большое влияние на силу растворенных кислот или оснований, поскольку в результате процесса диссоциации образуются противоположно заряженные ионы. [2]
Диэлектрическая проницаемость растворителя не является едилственным фактором, определяющим диссоциацию электролита и электрическую проводимость раствора. [3]
Диэлектрические проницаемости растворителя оказывают существенное влияние на электропроводность растворов электролитов. [4]
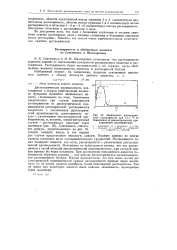 |
Зависимость растворимо-стей о-нитрофенола при 15 5 С по Семенченко от диэлектрической проницаемости растворителей. [5] |
Диэлектрическая проницаемость растворителя в первом приближении является функцией величины обобщенного момента. [6]
Диэлектрическая проницаемость растворителя и его окислительно-восстановительные свойства влияют на взаимодействия ион-ион и ион-растворитель, а следовательно, состояние ионов в смешанном растворе может быть принципиально иным по сравнению с водным. [7]
Диэлектрическая проницаемость растворителя - важный, но не решающий фактор ионизации электролита в растворе. Это видно из того факта, что в некоторых жидкостях, например в цианистоводородной кислоте, диэлектрическая проницаемость которой больше, чем у воды, электролиты хуже растворяются и ионизированы в меньшей степени. Большую роль при растворении и ионизации электролитов играет сила сольватации растворителя, которую количественно определить труднее, чем диэлектрическую проницаемость. [8]
Диэлектрическая проницаемость растворителя: ее рост уменьшает отталкивание полярных групп, благоприятствуя созданию конформации XXXIa и ХХХНа для жезо-формы и ХХХб и ХХХПб для рацемической формы. [9]
Диэлектрическая проницаемость растворителя - важный, но не решающий фактор ионизации электролита в растворе. Это видно из того, что в некоторых жидкостях, например в цианистоводородной кислоте, диэлектрическая проницаемость которой больше, чем у воды, электролиты хуже растворяются и ионизированы в меньшей степени. Большую роль при растворении и ионизации электролитов играет сольватация. Впервые это с особой ясностью подчеркнул Д. И. Менделеев, исследовавший зависимость плотности растворов электролитов от их состава и обнаруживший появление максимумов и минимумов на кривых плотность - состав. [10]
Диэлектрическая проницаемость растворителя не является единственным фактором, определяющим диссоциацию электролита и электрическую проводимость раствора. [11]
Диэлектрическая проницаемость D растворителя определяет величину всех электростатических взаимодействий. Влияние электрического поля на полярный растворитель состоит в частичной ориентации диполей растворителя, которому противостоит тепловая энергия. [12]
Если диэлектрическая проницаемость растворителя достаточно низкая, то даже сильные электролиты диссоциируют в очень незначительной степени ( см. рис. 4 - 2), и такие растворы имеют невысокую ионную силу. [13]
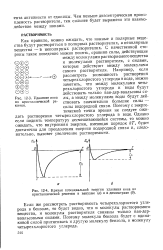 |
Кривая потенциальной энергии удаления иона из кристаллической решетки в вакууме ( а и в диэлектрике ( б. [14] |
Чем меньше диэлектрическая проницаемость растворителя, тем сильнее будет выражено это взаимодействие между ионами. [15]
Страницы: 1 2 3 4