Диэлектрическая проницаемость - растворитель
Cтраница 4
В этом случае важны диэлектрическая проницаемость растворителя и специфические взаимодействия растворителя с ионами ( см. разд. [46]
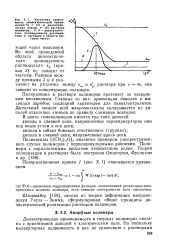 |
Частотная зависимость диэлектрической проницаемости е ( / и диэлектрических потерь е ( 2 раствора полимера. 3 4 - диэлектрические проницаемости растворителя и раствора в области высоких частот. [47] |
Во всей приведенной области диэлектрическая проницаемость растворителя е ( кривая 3) не зависит от частоты. [48]
Однако в ряде случаев диэлектрическая проницаемость растворителя играет второстепенную роль. Например, хлористый водород растворяется в этиловом спирте и дает сильный электролит, между тем раствор хлористого водорода в нитробензоле, диэлектрическая проницаемость которого почти такая же, как и этилового спирта, является слабым электролитом. Существенным здесь оказывается то обстоятельство, что молекула этилового спирта легко соединяется с ионом водорода и образует комплексный ион С2Н5ОН который и является формой существования иона водорода в спиртовом растворе. Нитробензол не образует такого соединения, поэтому степень диссоциации оказывается малой и раствор хлористого водорода в нитробензоле является слабым электролитом. Поскольку молекулы сильных электролитов в растворах почти полностью диссоциированы, то в реакциях между сильными электролитами в растворах участвуют фактически не молекулы, а отдельные ионы. [49]
Таким образом, не только диэлектрическая проницаемость растворителя влияет на поведение одного и того же электролита в неводных растворах. Причина электропроводности лежит во взаимодействии растворенного вещества с растворителем. [50]
С точки зрения влияния диэлектрической проницаемости растворителя на скорость как стадия ( 1), так и любая другая стадия, включающая реакцию дипольной молекулы с отрицательно заряженным ионом, может быть лимитирующей. [51]
Немаловажное значение имеет величина диэлектрической проницаемости растворителя: чем больше последняя, тем больше ослабляются связи между ионами электролита. [52]
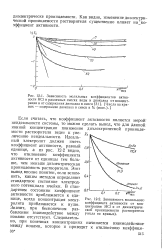
Как видно, изменение диэлектрической проницаемости растворителя существенно влияет на ко-эффициент активности. [54]
 |
Результаты определения электропроводности. [55] |
Сд возрастают с увеличением диэлектрической проницаемости растворителя, причем зависимость In Л д от обратной величины диэлектрической проницаемости 1 / е является, как правило, линейной. [56]
Наоборот, при увеличении диэлектрической проницаемости растворителя сила электростатического взаимодействия между ионами уменьшается в D раз. Поэтому полярные растворители, характеризующиеся большим значением диэлектрической проницаемости, способствуют образованию растворов с малой склонностью к возникновению ионных пар. Даже на сравнительно малых расстояниях взаимодействием ионов можно пренебречь ( q мал по величине), поэтому ионы можно считать практически изолированными. При увеличении температуры, как следует из ( VIII. Бьеррума q уменьшается и взаимодействие между ионами ослабляется на меньших расстояниях, что объясняется возрастанием энергии теплового движения ионов. Параметр Бьеррума имеет вполне определенное значение для каждого растворителя при заданных температуре и заряде ионов. [57]
Страницы: 1 2 3 4