Процесс - ионизация - металл
Cтраница 3
Образование на поверхности металла ( анода) пассивных пленок, нерастворимых в электролите и препятствующих протеканию процесса ионизации металла; при этом металл, приобретает более положительный потенциал. [31]
Образование на поверхности металла ( анода) пассивных пленок, нерастворимых в электролите и препятствующих протеканию процесса ионизации металла; при этом металл приобретает более положительный потенциал. [32]
Образование на поверхности металла ( анода) пассивных пленок, нерастворимых в электролите и препятствующих протеканию процесса ионизации металла; при этом металл приобретает более положительный потенциал. [33]
Ингибирующее воздействие некоторых добавок может быть связано с адсорбционным вытеснением с поверхности металла анионов, способствующих протеканию процесса ионизации металла. Таким путем, например, может быть объяснено тормозящее воздействие галоидных ионов на коррозию железа и никеля в кислых сульфатных растворах. [34]
Приложимость уравнений ( 1) и ( 2) могут иллюстрировать также опыты по исследованию влияния органических катионов на процесс ионизации металла амальгам, снятые методом концентрационной поляризации. На рис. 1 представлена кривая катодной и анодной поляризации капельного электрода из 0 001 М / л цинковой амальгамы. [35]
В следующий непосредственно за катодным анодный полупериод процесс ионизации адсорбированного водорода происходит, очевидно, с меньшим перенапряжением, чем процесс ионизации металла. Поэтому приведенные на рис. 1 анодные поляризационные кривые при всех частотах переменного тока для плотностей фарадеевского тока, меньших предельных, лежат выше анодной поляризационной кривой для постоянного тока. [36]
Направление в изменении потенциала ( сильное разблагораживание) показывает, что в щели должно наблюдаться либо торможение катодной реакции ионизации кислорода, либо ускорение процесса ионизации металла. Учитывая, что в стационарных условиях коррозия в щели меньше, чем на свободно омываемой электролитом поверхности, можно ожидать превалирующего торможения катодной реакции. [37]
Метод металлводородного электрода который может быть использовав для измерения рН в электродных процессах, сопровождающихся побочным выделением водорода, если ток основного процесса ( и процесса ионизации металла электрода) значительно ниже тока обмена водородного процесса. Этот метод основан на свойстве платиновых металлов и, в меньшей степени, никеля и железа быть обратимыми по отношению к водородному процессу. При прохождении тока через электролитическую ячейку выделяющийся водород адсорбируется металлом катода, потенциал которого после выключения тока будет в начальный период соответствовать потенциалу водородного электрода находящемуся s равновесии с ионами водорода в приэлектродном слое раствора. [38]
Скорость всякого коррозионного процесса протекающего по электрическому механизму, в том числе и развивающегося под лакокрасочной пленкой, определяется скоростью двух сопряженных реакций: анодной, заключающейся в процессе ионизации металла, и катодной, которая заключается в нейтральных электролитах в восстановлении кислорода, а в кислых - в выделении водорода. [39]
 |
Определение скорости саморастворения по кривым поляризации. [40] |
На рис. 46 приведены поляризационные кривые: катодная ( /) - - для процесса разряда ионов водорода ( кривая перенапряжения водорода) и анодная ( 2) - для процесса ионизации металла. [41]
В этих случаях не изменяется величина окислительно-воолановн тельного потенциала среды, но поскольку уменьшается величина первого критического потенциала, кривая катодной поляризации / пересекает кривую анодной поляризации не на участке, харак теризующем процесс ионизации металла, а уже на участке, харак геризующем пассивное состояние. [42]
Сравнение значений стационарных потенциалов железа ( потенциалов коррозии) в нейтральных электролитах ( - 0 3 - - 0 4 В) со значениями потенциалов образования окислов железа приводит к выводу, что уже при незначительном смещении потенциала железа или стали в положительную сторону от стационарного параллельно процессу ионизации металла на электроде должна протекать реакция окисления, приводящая к возникновению на поверхности окисных слоев. [43]
На аноде идет процесс ионизации металла. На катодных участках в зависимости от химического состава раствора могут идти самые разнообразные катодные реакции, равновесные потенциалы которых более положительны, чем потенциал анодного участка ( см. табл. 6): реакция электровосстановления кислорода, реакция разряда ионов водорода, реакция разряда ионов металла и другие. [44]
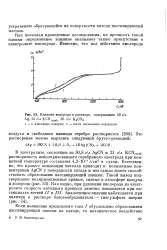 |
Влияние водорода в растворе, содержащем 48 г / л. [45] |
Страницы: 1 2 3 4