Процесс - изотермическое испарение
Cтраница 3
При подробном рассмотрении процесса изотермического испарения нетрудно убедиться, что процесс будет развиваться несколько сложнее ранее описанного. [31]
 |
Узловые точки системы, содержащей хлориды и сульфаты калия, натрия и магния в воде при 25 С. [32] |
Первые два этапа процесса изотермического испарения ( пренебрегая кристаллизацией оксидов и солей железа, карбоната магния, карбонатов других металлов второй группы и гипса) на диаграмме не изображены. [33]
Следует отметить, что процесс изотермического испарения не всегда заканчивается в эвтонической точке. В том случае, когда состав солевой массы раствора одинаков с составом выделяющейся твердой фазы, выпадение осадка не изменяет концентрации и соотношения солей в растворе, который высыхает здесь до конца. Подобная эвтоника называется конгруэнтной. Эвто-ника, в которой происходят нонвариантные превращения, способствующие дальнейшему протеканию процесса и приводящие к увеличению числа степеней свободы, называется ннконгруэнтной. Иногда ее называют не эвтонической, а переходной точкой. [34]
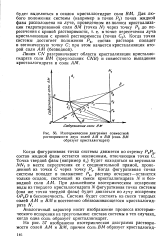 |
Изотермическая диаграмма совместной. [35] |
Аналогичный характер носит изображение процесса изотермического испарения на треугольнике состава системы в тех случаях, когда одна соль образует кристаллогидрат. [36]
Построение на диаграмме растворимости процессов изотермического испарения, смешения, растворения и выполнение с ее помощью количественных расчетов основано на материальном балансе системы; оно осуществляется с соблюдением следующих правил. [37]
Построение на диаграммах растворимости процесса изотермического испарения показано на рис. II. [38]
В качестве примера будет рассмотрен процесс изотермического испарения пробы системы ро. В дальнейшем из раствора будет кристаллизоваться соль ВХ, в поле кристаллизации которой находится фигуративная точка пробы. [39]
Он широко используется при расчете процессов изотермического испарения как в двухкомпонентных так и многокомпонентных системах. При его применении следует руководствоваться следующими соображениями. [40]
Ниже будут описаны типовые случаи процессов изотермического испарения и их изображение на диаграмме. Если фигуративная точка системы т0 в начальный момент проектируется в поле кристаллизации соли D, возможны два варианта, отличающиеся тем, что соотношение между солями С и В может быть больше или меньше отрезка, изображаемого следом плоскости AE D, на рисунке 5 - 11, а. [41]
Полученное уравнение изображает материальный баланс процесса изотермического испарения воды. [42]
На рис. 7 - 2 показан процесс изотермического испарения. Удаление воды до перемещения фигуративной точки ее состава в объем соли СХ не показано. [43]
 |
Изотермическая диаграмма растворимости тройной системы с образованием твердых растворов ( схема. [44] |
Рассмотрим, как изобразится на диаграмме процесс изотермического испарения. [45]
Страницы: 1 2 3 4