Процесс - катализ
Cтраница 3
Пенсом Берцелиусом открыт процесс катализа. [31]
Следовательно, в процессе катализа наиболее медленной стадией является сорбция кислорода, поэтому повышение концентрации кислорода увеличивает и скорость процесса, и возможную степень окисления. Однако при этом падает производительность аппарата из-за разбавления обжигового газа воздухом. [32]
Реакции эфирообразования относятся к процессам катализа кислотами. По современным воззрениям ион водорода никогда не бывает в свободном виде, а связан или с Н2О в виде иона гидроксония Н3О, или с молекулой спирта в виде ROHf, что облегчает протекание реакции ROH2 R COOHj R COOR Н3О в результате повышения числа активных столкновений. [33]
Реакции эфирообразования относятся к процессам катализа кислотами. По современным воззрениям ион водорода никогда не бывает в свободном виде, а связан или с Н2О в виде иона гидроксония Н3О, или с молекулой спирта в видеЕОН, что облегчает протекание реакции ROH2 R COOH; R COOR Н3О в результате повышения числа активных столкновений. [34]
Таким образом, в процессе катализа наиболее медленной из кинетических стадий является сорбция кислорода. Для увеличения степени окисления SO, следовало бы повышать концентрацию кислорода в газе, но при разбавлении газа воздухом уменьшается концентрация SO2 и производительность аппарата. Поэтому установлена наиболее рациональная концентрация SO. По мере протекания процесса возрастает Cso, и снижается Cso. [35]
Таким образом, в процессе катализа наиболее медленной из кинетических стадий является сорбция кислорода. Для увеличения степени окисления 5О2 следовало бы повышать концентрацию кислорода в газе, но при разбавлении газа воздухом уменьшаются концентрация SO2 и производительность аппарата. [36]
Таким образом, в процессе катализа наиболее медленной из кинетических стадий является сорбция кислорода. Для увеличения степени окисления SO2 следовало бы повышать концентрацию кислорода в газе, но при разбавлении газа воздухом уменьшаются концентрация SO2 и производительность аппарата. [37]
Соединения, получающиеся в процессе катализа, существуют лишь на поверхности катализатора и не образуют самостоятельных фаз. [38]
Противоречивы сведения о влиянии проводимости на процесс катализа. Разбиение катализаторов на три группы по их проводимости ( работы Даудена) и попытки связать проводимость ( через плотность электронов и электронные характеристики металлов) с каталитической активностью не дали желаемых результатов. [39]
Существует несколько различных теорий, объясняющих процесс катализа. Каждая из этих теорий - промежуточных соединений, активных центров и активных ансамблей, мультиплетная и электронная, дополняя и развивая друг друга, объясняют ускоряющее действие твердых катализаторов. [40]
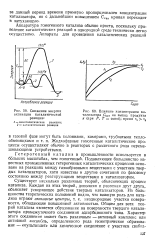 |
Снижение энергии.| Влияние концентрации катализатора Скат на выход продукта ( при Р, Т const. время т2. [41] |
Существует несколько различных теорий, объясняющих процесс катализа. Каждая из этих теорий, дополняя и развивая друг друга, объясняет ускоряющее действие твердых катализаторов. Общим для всех теорий катализа является образование на поверхности твердого катализатора промежуточного соединения адсорбционного типа. [42]
Густавсона к выводу, что в процессе катализа происходит образование комплексов реагента с гало-генидами алюминия. [43]
Остается бесспорным лишь одно: в процессе катализа имеется чрезвычайно тонкая специфичность взаимодействия гидрируемого органического соединения с катализатором - металлом; эта специфичность и обусловливает указанную выше избирательность в катализе. [44]
Густавсона к выводу, что в процессе катализа происходит образование комплексов реагента с гало-генидами алюминия. [45]
Страницы: 1 2 3 4