Процесс - окисление - железо
Cтраница 1
Процесс окисления железа при восстановлении нитробензола в принципе аналогичен процессу влажной коррозии железа з присутствии слабодействующих электролитов. В связи с тем, что, в отличие от процесса влажной коррозии, оба вещества, образующиеся в результате реакции ( 1), немедленно вступают в быстропротекающие реакции ( 2) и ( 3) с нитробензолом, окисление железа проходит значительно быстрее, чем во влажном воздухе. Однако несмотря на очень быстрое окисление железа, участвующего в процессе восстановления нитробензола в анилин, влияние степени измельчения и состава чугуна на скорость реакции то же, какое наблюдается при влажной коррозии железа в присутствии кислорода воздуха. Особенно активными являются чугуны, способные образовывать максимальное количество пар в присутствии электролитов, причем наиболее действенными являются пары феррит - графит и несколько более слабыми - пары перлит-графит. К таким чу-гунам относятся мягкие, богатые ферритом и графитом и легко поддающиеся измельчению. Ковкий чугун и сталь непригодны для восстановления нитробензола. [1]
Процесс окисления железа аналогичен процессу влажной коррозии его в присутствии электролитов. В связи с тем, что Fe ( OH) 2 и 2 ато на водорода реакции I немедленно вступают в быстротекущие реакции П и Ш, окисление железа происходит значительно быстрее, чей на влажном воздухе. Для восстановления применяются мягкие, богатые ферритом, перлитом и графитом серые чугуны. Большое значение на скорость процесса восстановления имеет степень дробления стружки, природа электролита, концентрация его и рН среды. [2]
Процессы окисления железа и его восстановления происходят при сварке беспрерывно. Восстановление железа из закиси, находящейся в металле, происходит преимущественно в задней части сварочной ванны, где температура более низкая. [3]
Процесс окисления железа при восстановлении нитробензола в принципе аналогичен процессу влажной коррозии железа з присутствии слабодействуюших электролитов. В связи с тем, что, в отличие от процесса влажной коррозии, оба вещества, образующиеся в результате реакции ( 1), немедленно вступают в быстропротекающие реакции ( 2) и ( 3) с нитробензолом, окисление железа проходит значительно быстрее, чем во влажном воздухе. Однако несмотря на очень быстрое окисление железа, участвующего в процессе восстановления нитробензола в анилин, влияние степени измельчения и состава чугуна на скорость реакции то же, какое наблюдается при влажной коррозии железа в присутствии кислорода воздуха. Особенно активными являются чугуны, способные образовывать максимальное количество пар в присутствии электролитов, причем наиболее действенными являются пары феррит - графит и несколько более слабыми - пары перлит-графит. К таким чу-гунам относятся мягкие, богатые ферритом и графитом и легко поддающиеся измельчению. Ковкий чугун и сталь непригодны для восстановления нитробензола. [4]
Изучение процесса окисления железа имеет большое значение для исследования механизма окисления нержавеющих и окали-ностойких сталей. [5]
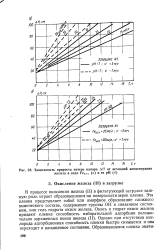 |
Зависимость прироста потерь напора ДЯ от исходной концентрации железа в воде РеИСх ( и и ее рН ( б. [6] |
В процессе окисления железа ( II) в фильтрующей загрузке важную роль играет образовавшаяся на поверхности зерен пленка. Эта пленка представляет собой или аморфное образование сложного химического состава, содержащее группы ОН в связанном состоянии, или гель гидрата окиси железа. Однако при отсутствии кислорода адсорбционная способность пленки быстро снижается и она переходит в насыщенное состояние. [7]
 |
Жаростойкость чистых металлов.| Влияние температуры на скорость окисления Am железа на воздухе. [8] |
В процессе окисления железа и стали на поверхности растут несколько оксидов, у которых химический состав, кристаллическая структура и защитные свойства различны. [9]
Быстро завершается процесс окисления железа ( II) перманга-натом калия, при этом образующийся хлопьевидный осадок гидроокиси марганца каталитически ускоряет окисление железа. [10]
Диффузионный характер процесса окисления железа предопределяет неравномерность скорости реакции. [11]
Одновременно с процессами окисления железа на стадии капли и ванны происходит окисление легирующих элементов и примесей. Окисленность жидкого металла сварочной ванны определяется концентрацией элементов-раскислителей. Для раскисления жидкого металла сварочной ванны в сердечник порошковой проволоки вводят кремний, марганец, алюминий, титан, редкоземельные элементы. [12]
По этой схеме процесс окисления железа начинается с его коррозии, в результате чего получается гидрат закиси железа, который затем окисляется в соответствующий окисел в зависимости от условий окисления. [13]
При осаждающем раскислении процессы окисления железа и его восстановления происходят при сварке беспрерывно. Окисление железа происходит в передней части ванны, где температура более высокая. Восстановление железа из закиси, находящейся в металле, происходит преимущественно в задней части сварочной ванны, где температура более низкая. [14]
При небольшой скорости процесса окисления железа образование гидрата закиси железа происходит медленнее, чем его окисление в гидрат окиси, вследствие чего в реакционной среде гидрат закиси отсутствует, и получение продуктов присоединения Fe ( OH) 2 Fe ( OH) 3 невозможно. Поэтому при окислении металлического железа кислородом воздуха может получаться только один окисел - гидрат окиси железа. [15]
Страницы: 1 2 3 4