Процесс - переаминирование
Cтраница 2
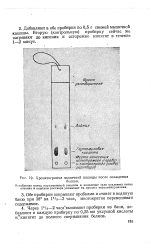 |
Хроматограмма мышечной кашицы после осаждения. [16] |
Ослабление пятна глутаминовой кислоты и появление ( или усиление) пятна аланина в опытном растворе указывает на процесс переаминирования. [17]
Дихлорпро-пионовая кислота угнетает синтез белка как на стадии включения аминокислот в белки, так и на более ранних этапах - при синтезе аминокислот в результате угнетения процессов переаминирования. [18]
Оказалось, что у-аминокислота является биохимически интересным и важным веществом; так, например, будучи широко распространена в растительных и животных организмах, она участвует в процессах биохимического переаминирования в качестве партнера у-кетоглутаровой кислоты. [19]
Всосавшиеся из кишечника аминокислоты используются для синтеза белков органов и тканей, а также для образования ряда необходимых организму веществ, например глютатиона, креатина, карнозина и др. Аминогруппы, входящие в состав аминокислот, могут быть в процессе переаминирования переданы на кетокислоты, при этом образуются аминокислоты, соответствующие вступившим в реакцию кетокислотам. В организме происходит постоянное разрушение аминокислот, причем входившие в них углерод и водород покидают организм в виде СО2 и Н2О, а азот выделяется в составе органических соединений ( мочевины, мочевой кислоты, креатинина) и аммонийных солей. [20]
В результате этой реакции образуются глютаминовая и пировиноградная кислоты. Процессы переаминирования ускоряются ферментами трансаминазами, или аминотрансфе-разами. В опыте, проводимом in vitro, образование пиро-виноградной кислоты при переаминировании можно обнаружить по ее способности давать фенилгидразон при обработке раствором динитрофенилгидразина. Фенилгидразон экстрагируют из раствора толуолом. Экстракт дини-трофенилгидразона пировиноградной кислоты окрашивается при добавлении спиртового раствора едкого кали в красный цвет. [21]
Некоторые растения содержат значительные количества - ме-тиленпроизводных глутаминовой кислоты и глутамина ( стр. Описаны процессы переаминирования f - метиленглутаминовой кислоты и f - метиленглутамина ( стр. Фауден [112] нашел, что экстракты из тканей ростков арахиса дезамидируют 7-метиленглутамин. Глутамин дезамидируется этими тканевыми препаратами значительно медленнее. [22]
Аспарагин и глютамжн имеют также большое значение как резерв-дикарбоновых кислот для осуществления реакции ферментативного пере-аминирования. В процессе переаминирования участвуют не только свободные аспарагиновая и глютаминовая кислоты, но также аспарагин и глютамин, которые к тому же способны к взаимопревращению. Наконец, по данным В. А. Кретовича, амидная группа предохраняет аспарагиновую-и глютаминовую кислоты от окислительного распада. Дикарбоновые аминокислоты в значительных количествах входят в состав растительных белков, поэтому превращения этих аминокислот и их амидов играют существенную роль в азотном обмене у растений. [23]
Показано, что первой аминокислотой, образующейся в растении, является аланин, далее идут дикарбоновые аминокислоты - аспарагиновая и глутаминовая. Основные аминокислоты и ароматические аминокислоты образуются позже, в результате процессов переаминирования. Тот факт, что первой аминокислотой, синтезируемой в растениях в результате переработки аммиака является аланин, по-видимому, обусловлен тем, что в растениях в качестве постоянного метаболита в процессе дыхания всегда образуется пировиноградная кислота, которая очень легко подвергается восстановительному аминированию аммиаком с образованием аланина. Применяя азотную подкормку, меченную тяжелым изотопом азота N15, удалось показать, что синтезированные за счет внесеннего в подкормку минерального азота аминокислоты быстро идут на синтез белковых веществ растений. Оказалось, что весь путь превращений внесенного в подкормку минерального азота, от почвы до конституционных белков протоплазмы листьев растений, измеряется при интенсивно идущем синтезе 3 - 4 часами. [24]
Совершенно непонятно, откуда автор взял положение о том, что начальной реакцией процесса аминирования всегда является образование глутаминовой кислоты. Есть, конечно, все основания считать, что образующиеся при амини-ровании пировиноградной и щавелевоуксусной кислот аланин и аспарагиновая кислота быстро подвергаются процессу переаминирования с кетоглутаровой кислотой, в результате чего образуется глутаминовая кислота. Нет, однако, никаких доказательств тому, что первоначально всегда образуется глутаминовая кислота, которая путем переаминирования дает аспарагиновую кислоту и аланин. [25]
Оксалоацетат, пируват и глиоксилат обычно легко обнаруживаются в тканях большинства высших растений, однако сообщения о нахождении в растениях других кетокислот немногочисленны, хотя, по-видимому, для каждой кетокислоты имеется по крайней мере по одному сообщению такого рода [64] i. Возможно, что в растениях эти кетокислоты очень быстро обмениваются, причем они могут образоваться и потребляться в каком-то одном локализованном участке в клетке, так что концентрация их, достаточная для поддержания процесса переаминирования, может быть недостаточно высокой для того, чтобы их можно было обнаружить. Интересно, что растительные аминотрансферазы локализуются преимущественно в митохондриях [11, 75], в которых по крайней мере оксалоацетат и а-кетоглутарат синтезируются в наибольшем количестве. [26]
Установлено, что в результате образования аспарагина и глютамина происходит обезвреживание аммиака, накапливающегося в высших растениях при дезаминировании аминокислот или обильном аммиачном питании при недостатке у растений углеводов. Кроме того, аспа-рагин и глютамин имеют большое значение как резерв дикарбоновых кислот для осуществления реакции ферментативного переаминирования. В процессе переаминирования участвуют не только свободные аспарагиновая и глютаминовая кислоты, но также аспарагин и глютамин, которые к тому же способны к взаимопревращению. Наконец, по данным В. А. Кретовича, амидная группа предохраняет аспарагиновую и глютаминовую кислоты от окислительного распада. Дикарбоновые аминокислоты в значительных количествах входят в состав растительных белков, поэтому превращения этих аминокислот и их амидов играют существенную роль в азотном обмене у растений. [27]
Пиридоксаль-5 - фосфат принимает участие в ферментативных реакциях переаминирования между амино - и а-кетокислотами, декарбоксилирования и рацемизации а-аминокислот, в реакциях расщепления и конденсации ( 5 - и у-заме-щенных а-аминокислот. Реакция переаминирования была открыта советскими биохимиками Браунштейном и Крицман. Шемякин и Браунштейн, а затем Метцлер, Икава и Снел показали, что в процессах переаминирования участвуют шиффовы основания, которые образуются при реакции пиридоксальфосфата и аминокислоты. [28]
В недавнее время получены очень важные данные, указывающие на влияние пиридоксина на белковый обмен. Именно фосфор илироваиный пиридоксаль ( фосфопиридоксаль) участвует в реакции переаминирования ( стр. В таком случае следует признать, что система фосфопиридоксаль - фосфопиридоксамин выполняет коферментную функцию в важном для обмена аминокислот процессе переаминирования. [29]
В результате распада аминокислот клетка получает ионы аммония, необходимые для формирования собственных аминокислот. Бактериальные клетки способны синтезировать все 20 аминокислот. Ведущими из них являются аланин, глютамин, аспарагин. Они включаются в процессы переаминирования и трансаминиро-вания. В белковом обмене процессы синтеза преобладают над распадом, при этом происходит потребление энергии. [30]
Страницы: 1 2 3