Процесс - сольватация
Cтраница 2
Изучен процесс сольватации активных центров в этих и других системах фрагментами собственной цепи. [16]
Энергетика процесса сольватации электролитов для неводных растворителей менее изучена, чем для водных. Имеется ограниченное число надежных данных. К ним относятся значения теплот и энергий сольватации ряда электролитов, полученные Мищенко и Измайловым. [17]
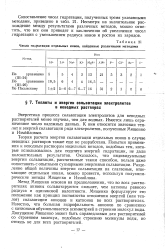 |
Числа гидратации отдельных ионов, найденные различными методами. [18] |
Энергетика процесса сольватации электролитов для неводных растворителей менее изучена, чем для водных. Имеется лишь ограниченное число надежных данных. К ним относятся значения теп-лот и энергий сольватации ряда электролитов, полученные Мищенко и Измайловым. [19]
Энергетика процессов сольватации электролитов для неводных растворителей менее изучена, чем для водных. Имеется лишь ограниченное число надежных данных. [20]
Поскольку скорости процессов сольватации, диссоциации и ассоциации весьма велики, то, по-видимому, процесс массопередачи для химически нереагирующих систем всегда протекает в диффузионной области. [21]
Поскольку теплота процесса сольватации является характеристикой прочности сольватации данного акцептора различными донорными растворителями, калориметрические измерения теплот сольватации предоставляют простую возможность оценки донорной способности. [22]
В результате процесса сольватации в растворе должны присутствовать не свободные ионы, а ионы с сольватной оболочкой. Как уже отмечалось, Бокрис и Конвей различают первичную и вторичную сольватную оболочки. Для понимания многих электрохимических процессов важно знать, сколько молекул растворителя входит во внутреннюю сольватную оболочку. Это количество молекул называется числом сольватации пс, или, в случае водных растворов, числом гидратации ионов пг. Они имеют относительное значение и дают ориентировочные сведения о члсле молекул растворителя, входящих во внутренний слой. Различные методы определения чисел сольватации приводят к значениям, существенно отличающимся друг от друга. В методе Улиха предполагается, что образование внутреннего гидратного слоя подобно замерзанию воды. Такое представление разделяют и многие другие авторы. Эли и Эванс, например, сравнивают сольватный слой с микроскопическим айсбергом, сформировавшимся вокруг частицы растворенного вещества. [23]
В результате процесса сольватации в растворе должны присутствовать не свободные ионы, а ионы с сольватной оболочкой. Как уже отмечалось, Бокрис и Конвей различают первичную и вторичную сольватную оболочки. Для понимания многих электрохимических процессов важно знать, сколько молекул растворителя входит во внутреннюю сольватную оболочку. Это количество молекул называется числом сольватации пс, или, в случае водных растворов, числом гидратации ионов пг. Они имеют относительное значение и дают ориентировочные сведения о числе молекул растворителя, входящих во внутренний слой. Различные методы определения чисел сольватации приводят к значениям, существенно отличающимся друг от друга. В методе Улиха предполагается, что образование внутреннего гидратного слоя подобно замерзанию воды. Такое представление разделяют и многие другие авторы. Эли и Эванс, например, сравнивают сольватный слой с микроскопическим айсбергом, сформировавшимся вокруг частицы растворенного вещества. [24]
В результате процесса сольватации в растворе появляются мо-лекулярно-ионные группы постоянного или переменного состава - сольваты или гидраты. [26]
 |
Модель ионной кающими в растворах сильных электроли-атмосферы TQB gM6CTO практически недоступного ра. [27] |
В результате процесса сольватации изменяются размеры растворенных частиц, плотность их заряда, а также вязкость всего раствора в целом. С увеличением концентрации раствора электролита уменьшается среднее расстояние между противоположно заряженными ионами. При этом растет вероятность образования длительно существующих ионных пар, так называемых ионных двойников и тройников, основное отличие которых от молекул заключается в большей длине связи и наличии взаимодействующих с ионной парой молекул растворителя. Итак, увеличение концентрации раствора электролита приводит к тому, что во взаимодействии между растворенными частицами более важную роль начинают играть близкодействующие силы химической связи. Природа и энергия этих сил зависит от специфических свойств взаимодействующих частиц. Поэтому с ростом концентрации увеличивается различие в свойствах растворов электролитов одинаковой концентрации, но разного химического состава. [28]
Определяющая роль процессов сольватации в химических реакциях может быть проиллюстрирована также многими другими примерами. Важное значение при этом имеет установление зависимости термодинамических, кинетических и структурных характеристик сольватации от общих свойств атомно-молекулярных частиц, природы и состава растворителя, внешних условий. [29]
В результате процесса сольватации в растворе должны присутствовать не свободные ионы, а ионы с сольватной оболочкой. Бок-рис и Конвей ( Bockris, Conway, 1954) различают первичную и вторичную сольватную оболочки. В первую из них включены лишь те молекулы растворителя, которые прочно связаны с ионом и перемещаются вместе с ним. Во вторичную оболочку - все молекулы воды, состояние которых отличается от их состояния в чистом растворителе. Для многих электрохимических процессов важно знать, сколько молекул растворителя входит во внутреннюю соль-ватную оболочку. Эти числа имеют относительное значение и дают лишь ориентировочные сведения о количестве молекул воды, входящих во внутренний слой. Различные методы определения чисел гидратации приводят к значениям, которые значительно отличаются друг от друга. [30]
Страницы: 1 2 3 4
