Процесс - выделение - металл
Cтраница 2
Как видно из этого рисунка, процесс выделения металла затруднен в тем большей степени, чем выше концентрация этилендиамина. При увеличении последней одновременно повышается рН электролита. Если концентрацию водородных ионов увеличить добавлением соляной кислоты, то кривая катодной поляризации смещается в положительную сторону, причем смещение наиболее заметно в начальной части вертикальной ветви. Такое изменение поляризации обусловлено, по-видимому, понижением потенциала выделения водорода в результате уменьшения рН раствора. [16]
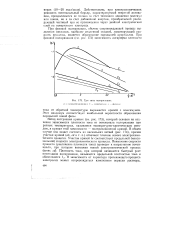 |
Три типа поляризации. [17] |
При фазовой поляризации, обычно сопровождающей процесс выделения металлов, наиболее медленной стадией, лимитирующей ско-рссть процесса, является образование зародышей кристаллов. [18]
При фазовой поляризации, обычно сопровождающей процесс выделения металлов, наиболее медленной стадией, лимитирующей скорость процесса, является процесс образования зародышей кристаллов. При фазовой поляризации ( см. рис. 192) зависимость логарифма плотности тока от обратной температуры выражается кривой, проходящей через максимум. Этот максимум соответствует наибольшей вероятности образования зародышей новой фазы. [19]
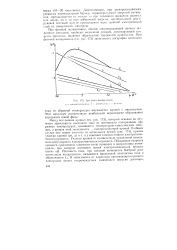 |
Три типа поляри. чацин. [20] |
При фазовой поляризации, обычно сопровождающей процесс выделения металлов, наиболее медленной стадией, лимитирующей ско-рссть процесса, является образование зародышей кристаллов. [21]
Как и протекание других электрохимических реакций, процесс выделения металла на ртути и амальгаме является стадийным. В общем случае при электроосаждении могут происходить: диффузия реагирующей частицы к электроду, ее химическое превращение в объеме раствора или у поверхности электрода с последующей адсорбцией, первичная адсорбция с последующей гетерогенной химической реакцией, частичная десольватация или потеря лигандов, разряд и диффузия атома вглубь жидкой фазы электрода. Отдельные стадии этого сложного процесса, за исключением стадии диффузии и разряда, могут отсутствовать. При исследовании осаждения металлов экспериментально удается выделить стадии диффузии, химической реакции, адсорбции и разряда. [22]
Пассивирование растущего кристалла может происходить также при замедлении процесса выделения металла на его гранях, например, при понижении плотности тока на этих гранях вследствие того, что по мере роста кристалла активная поверхность его растет, а плотность тока при постоянной силе тока уменьшается. [23]
Хотя ясно, что потенциал полуволны является характеристическим свойством окислительно-восстановительной системы, для процесса выделения металла это не является столь же очевидным. При потенциале середины волны концентрация разряжающихся ионов равна половине концентрации в глубине раствора, и, следовательно, может показаться на первый взгляд, что потенциал, соответствующий этой точке, должен зависеть от концентрации ионов в объеме раствора. Это было бы верно, если бы катод состоял из того же чистого металла, который на нем выделяется; однако на ртутном капельном электроде образуется сплав ( амальгама), концентрация которого меняется от нуля в начале волны до некоторой величины в конце волны. Величина эта зависит от силы диффузионного тока и, следовательно, от концентрации электролита. [24]
С начала 1930 - х годов Г. А. Разуваевым и М. М. Котоном [62] для выяснения химизма процесса выделения металла из его органических соединений действием водорода изучались такие реакции применительно к ртутноорганическим соединениям. Эта реакция ныне широко используется в синтетических целях. [25]
Именно такая связь между перенапряжением к плотностью тока вытекает из допущения, что скорость всего процесса выделения металла определяется кинетикой образования трехмерных зародышей. Вероятность образования зародыша, а следовательно, и скорость электроосаждения, выражаемая плотностью тока, будут в этом случае экспоненциально зависеть от работы образования зародыша. [26]
Именно такая связь между перенапряжением и плотностью тока вытекает из допущения, что скорость всего процесса выделения металла определяется кинетикой образования трехмерных зародышей. [27]
Появление на поляризационных кривых ветви /, так же как и в других растворах солей палладия, свидетельствует о сильном торможении процесса выделения металла уже при самых низких плотностях тока. Это явление, по-видимому, также обусловлено пассивированием поверхности катода в результате ионизации молекулярного кислорода. [28]
Этот ряд составлен на основании величин катодной поляризации Д, которые определены как разница между стационарным потенциалом палладия и вертикальной ветвью кривой, характеризующей процесс выделения металла. Как следует из этого ряда, минимальная катодная поляризация наблюдается в растворах тетрахлорпалладоата, а максимальная - в электролитах, содержащих этилендиамминовые и цианистые комплексы палладия. Следует отметить, что в последнем случае металлический палладий не выделяется и поэтому величину катодной поляризации определяет ветвь выделения водорода. [29]
При просмотре обширного литературного экспериментального материала по электролитической поляризации, в особенности при низких плотностях тока, можно прийти к выводу, что имеется какая-то критическая величина напряжения, ниже которой процесс выделения металла протекает с чрезвычайно низкой скоростью. [30]
Страницы: 1 2 3 4