Процесс - выделение - металл
Cтраница 3
 |
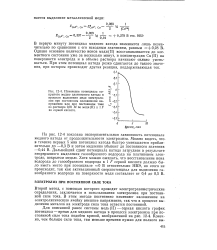
Кривые выделения металла я водорода. [31] |
Если кривые Е Ме и Е н пересекаются, то до плотности / 1 будет происходить выделение исключительно металла; до плотности тока / 2, как и во втором случае, будет происходить параллельное выделение водорода с преобладанием процесса выделения металла. [32]
Рассмотрим вторую фазу выделения металла - осаждение металла на электроде. Процесс выделения металла на электроде зависит от скорости реакции восстановления ионов металла. В случае электролиза большинства простых солей восстановление ионов происходит с очень большой скоростью. В случае электролиза комплексных солей на электроде протекает реакция, идущая с ограниченной скоростью: величина этой скорости зависит от стойкости комплекса. Чем более стойким является электролизуе-мый комплекс, тем медленнее идет электролиз при том же значении потенциала. Например, медь в количестве 0 3 г из аммиачного комплекса выделяется за 13 - 20 минут, а из более стойкого цианидного комплекса - за 25 - 30 минут. [33]
Сильное влияние на процесс выделения металла и строение частиц в растворе могут оказывать примеси, и в частности вода. Как правило, органические растворители, особенно применяемые для технологических целей, содержат примеси продуктов их разложения и синтеза. Влияние примесей может проявляться в их адсорбции на электродах с образованием других веществ, в изменении строения двойного электрического слоя и участии в реакции как комплексообразователя. Очевидно, что технологический электролит должен быть малочувствительным к этим примесям. [34]
Анализ вышеприведенных экспериментальных данных показывает, что протекание указанных окислительно-восстановительных реакций на мембранах не может быть связано с наличием у них каких-либо специфических химических или каталитических свойств, поскольку они должны были бы проявиться и при отсутствии тока в электролизере. Это дает возможность объяснить процессы выделения металла и кислорода на мембране следующим образом. Практическое отсутствие конвекции в молекулярного размера порах ионита и заполнение их малопроводящим осадком гидроокисей способствует при прохождении электрического тока повышению температуры в узкой зоне столкновения фронтов ОН и Мея ионов. [35]
Кольшюттер и Торичелли [5] выяснили условия, при которых рост кристаллов прекращается. Они заметили, что растущий монокристалл серебра пассивируется при замедлении процесса выделения металла на его грани, вызываемом уменьшением истинной плотности тока вследствие роста поверхности кристалла. [36]
Возможность влияния температуры как на скорость катодного процесса, так и на величину активной поверхности электрода затрудняет определение реальной энергии активации и делает приближенной величину эффективной энергии активации выделения палладия. Из всех исследованных электролитов энергия активации электроосаждения палладия может служить характеристикой процесса выделения металла только в хлоридном растворе. В сильно щелочном электролите этому препятствует очень малый наклон вертикальной ветви, соответствующей выделению самого палладия. В остальных растворах на всех ветвях кривых параллельно протекает несколько процессов и поэтому определяемая величина энергии активации не может служить точной характеристикой лишь одного из них. О она примерно равна 12 ккал / молъ. Эта величина весьма незначительно превышает энергию активации электроосаждения меди и цинка из цианистых электролитов. Однако, учитывая возможности изменения активной поверхности катода при повышении температуры, нельзя из этих данных сделать однозначный вывод о том, что процесс выделения палладия затруднен в большей степени. [37]
Интересный пример блокирования поверхности электрода мы рассмотрим в следующем разделе; он в одинаковой степени относится как к случаю жидких, так и твердых электродов. А теперь рассмотрим некоторые данные о влиянии адсорбированных, анионов и органических катионов на процесс выделения металлов на жидком электроде, так как заранее можно ожидать, что влияние адсорбированных ионов на жидком и твердом ( кристаллическом) электродах во многих случаях будет различным. [38]
Второй метод, с помощью которого проводят электрогравиметрические определения, заключается в использовании электролиза при постоянной силе тока. В этом методе постепенно изменяют наложенное на электролитическую ячейку внешнее напряжение, так что в процессе выделения металла на электроде сила тока остается постоянной. [40]
Можно предполагать, что значительная величина катодной поляризации при низких плотностях тока обусловлена пассивированием поверхности катода в результате параллельно протекающей реакции ионизации молекулярного кислорода. Вследствие взаимодействия образующихся окислителей с поверхностью палладия на катоде, по-видимому, создается пассивирующий слой, препятствующий процессу выделения металла. Заметное электроосаждение палладия начинается лишь тогда, когда скорость обновления поверхности значительно превышает скорость ее пассивации. [41]
Из трех групп примеров первого типа экстракции, приведенных в табл. 22, в процессах переработки ядерного топлива важ ную роль играет только образование оксониевой соли. Этот вид экстракции имеет место в системах, где в качестве компонента участвуют сильные минеральные кислоты, но все же другие типы экстракции имеют более важное значение в процессах выделения металлов. Образование оксониевой соли происходит при наличии кислоты и органического растворителя, содержащего кислород. [42]
Металлические шламы, содержащие оксиды или гидроксиды металлов, образуются, например, в процессах травления металлов кислотой, в установках для электропокрытия металлов, а также в других процессах обработки поверхности. Особый интерес представляет выделение из шламов железа и цинка, а также процесс отделения железа от цинка. Процесс выделения металлов из отходов должен быть достаточно экономичным, чтобы явиться практической альтернативой широко распространенному методу сброса отходов в водоемы. [43]
 |
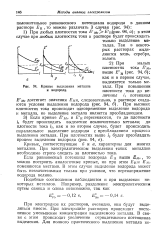
Прибор для электролиза со ртутным катодом. [44] |
При этом на последнем выделяются железо, хром, цинк, никель, кобальт, олово, медь, висмут и серебро. Для ускорения процесса выделения металлов слой ртути медленно перемешивают механической мешалкой. Выделение на ртутном катоде продолжают до тех пор, пока капля раствора при прибавлении к ней разбавленного раствора феррицианида калия Ks [ Fe ( CN) 6 ] покажет отрицательную реакцию на железо. [45]
Страницы: 1 2 3 4