18-крауна
Cтраница 2
Метод, состоящий в использовании при циклизации алкилирую-щего агента, содержащего слабо нуклеофильные, легко уходящие тозильные группы, привел к значительному повышению выхода 18-краун - 6 по сравнению с методом Педерсена. [16]
Эти принципы легли в основу разработки многочисленных эффективных методов введения заместителя к атому азота пиррола, использующих гидроксид калия в диметилсульфоксиде [72] или бензоле в присутствии 18-краун - 6 [73], этилатталлия [74], условия межфазного катализа [75] и, конечно, реакции пиррил-аниона, генерированного с использованием бутилли-тия. [17]
 |
Кристаллическая структура и конформация комплекса дициклогексил-18 - краун-6 ( изомер А с La ( NOs s (, воспроизведено с любезного разрешения chemical Society. [18] |
Кнехель и др. [90] выделили бледно-желтые иглообразные кристаллы состава IX ( табл. 3.6) смешиванием раствора U02 ( N03) 2 бР О в толуоле или эфире и раствора 18-краун - 6 в эфире и подтвердили методами ИК -, КР - и ЯМР-спектроскопии, что эти кристаллы являются краун-комцлексом. [19]
Что касается методов исследования, отличных от ЯМР, Лизенганг и др. [ 175], используя ультразвуковое поглощение ( 9 - 340 МГц), измерили величи-ны йобр и йдисс Для Реакции комплексообразования 18-краун - 6 с ионами К, Cs [174], Li, Na, NH, Ag, Ca2, Tl в воде, fle Янг и др. [176] изучили кинетику реакции обмена трет - ВиШ % PFe - между двумя различными краун-эфирами. [20]
Что касается методов исследования, отличных от ЯМР, Лизенганг и др. [ 175], используя ультразвуковое поглощение ( 9 - 340 МГц), измерили величи-ны обр и дисс для Реакции комплексообразования 18-краун - 6 с ионами К 1, Cs [174], Li, Na, NH, Ag, Ca2, Tl в воде, fle Янг и др. [176] изучили кинетику реакции обмена pem - BuNHj PFe - между двумя различными краун-эфирами. [21]
Готоаят суспензию 2 93 г ( 30 0 ммоль) ацетата калия, высушенного в вакууме над Р4Ою, в растворе 4 41 г ( 23 2 ммоль) нернлхлорида К-336 и 0 53 г ( 2 0 ммоль) 18-крауна - 6 ( осторожно) в 25 мл безводного апето-нитрила и смесь перемешивают в течение 4 ч на водяной бане при 60 С. [22]
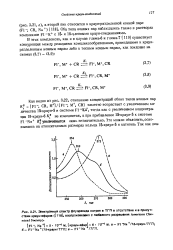 |
Электронный спектр флуоренида натрия в ТГГТ в отсутствие и в присутствии краун-эфиров (, воспроизведено с любезного разрешения American Chemical Society. [23] |
Как видно из рис. 3.22, отношение концентраций обоих типов ионных пар К0 [ F1 -, CR, M41 / [ F1 -, M, CR ] заметно возрастает с увеличением количества 15-краун - 5 в системе Fl-Ka, тогда как с увеличением концентрации 18-краун - 6 К не изменяется, а при прибавлении 15-краун - 5 к системе Fl-Na К. [24]
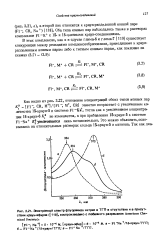 |
Электронный спектр флуоренида натрия в ТГГТ в отсутствие и в присутствии краун-эфирое (, воспроизведено с любезного разрешения American Chemical Society. [25] |
Как видно из рис. 3.22, отношение концентраций обоих типов ионных пар К9 [ F1 -, CR, M41 / [ F1 -, M, CR ] заметно возрастает с увеличением количества 15-краун - 5 в системе Fl-K a, тогда как с увеличением концентрации 18-краун - 6 К не изменяется, а при прибавлении 15-краун - 5 к системе Fl - Na К. [26]
О взаимодействии гидразина с хлороформом и основанием, в результате которого образуется диазометан, Штаудингер сообщил около 60 лет назад, но реакция не получила большого распространения. Однако применение 18-краун - 6-эфира как межфазного катализатора в этой реакции сделало ее препаративно полезным методом. [27]
Соотношение Z / E-изомеров в МФК-реакции Виттига не отличается от такового при использовании алкоксидного метода. При использовании системы 18-краун - 6 / карбонат калия или грет-бутоксид калия было отмечено влияние растворителя ла стереохимию образующихся олефинов. [28]
Если использовать 5-молярный избыток хлорида и более разбавленные растворы, то выходы повышаются. Интересно отметить, что добавление 18-краун - 6 замедляет реакцию обмена, поскольку положительный заряд в комплексе крауна с диазо-ниевой группой делокализован, что ослабляет способность к нуклеофильному замещению. Если пдонять во внимание величину кислотности NH-связи, то отнесение этой реакции к МФК-процессам вызывает сомнение ( см. разд. [29]
Следует отметить, что при использовании в качестве основания тетрабутил-аммонийгидроксида в тетрагидрофуране 18 - и 21-членные циклические эфиры образуются с низкими выходами, а большая часть исходного материала полимеризуется. Заслуживает внимания также, что в синтезе 18-краун - 6 с использованием в качестве основания трет-бутилалкоголята калия осаждается только половина ожидаемого количества n - толуолсульфоната калия; очевидно, в данном случае 1 моль-экв иона калия удерживается в комплексе, образующемся при циклизации. Интересно, что эксперименты с конкуренцией между ди-п-толуолсульфонатом диола и некоторыми диолами в присутствии трег-бутилалкоголята калия в качестве основания показывают, что существует значительное преимущество для образования 21-членного циклического эфира по сравнению с 15 -, 18 - или 24-членными циклами. [30]
Страницы: 1 2 3