Процесс - водородная деполяризация
Cтраница 1
Процесс водородной деполяризации проходит в несколько стадий: диффузия гидратированных ионов водорода к катоду, дегидратация, адсорбция и разряд ионов, рекомбинация ионов в молекулу и удаление молекул от поверхности катода. [1]
Процесс водородной деполяризации имеет также значение и в некоторых условиях почвенной коррозии при низких значениях рН и большой кислотности почв. [2]
Процесс водородной деполяризации проходит в несколько стадий: диффузия гидратиро-ванных ионов водорода к катоду; дегидратация, адсорбция и разряд ионов; рекомбинация ионов в молекулу и удаление молекул от поверхности катода. [3]
При параллельном протекании процессов кислородной и водородной деполяризации образующаяся твердая фаза гидратированных окислов слабо сцепляется с поверхностью корродирующего металла и в значительном количестве поступает в питательную воду. Поскольку в работающем оборудовании осуществляется непрерывное движение воды, не задержавшиеся на корродирующей поверхности частицы твердой фазы Fe ( OH) 2 и Fe ( OH) 3 увлекаются потоком воды и удаляются от места, где они образовались. [4]
При нормальной концентрации кислорода процесс водородной деполяризации также имеет место, однако скорость его меньше, так как потенциал стали в этих условиях более положителен и равен - 0 48 в. Таким образом, при уменьшении концентрации кислорода соответственно понижается и скорость коррозии, однако при небольших концентрациях кислорода или при его отсутствии она остается еще заметной. [5]
При электрохимической коррозии в углекислых средах процесс водородной деполяризации осуществляется двумя путями: 1 - ионами рэдроясония яэ глубины раствора; 2 - ионами водорода. [6]
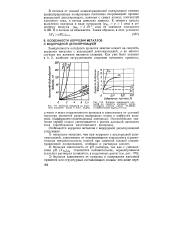 |
Влияние примесей на кинетику коррозии цинка в 0 5 - н. H2SO.| Влияние содержания примесей на скорость коррозии цинка ( исходная чистота цинка 99 988 % в разбавленной HSSO4 ( 18 г / л. [7] |
В отличие от ионной концентрационной поляризации газовая концентрационная поляризация постоянно сопровождает процесс водородной деполяризации, начиная с самых низких плотностей катодного тока, и всегда довольно заметна. К моменту начала выделения водорода в виде пузырьков ( рн Р - 1 атм) в атмосферу воздуха ( рн 5 - 10 - 7 атм) ее значение составляет 0 186 В и дальше не изменяется. [8]
Процессы коррозионного разрушения металла, протекающие с выделением водорода, называют процессом водородной деполяризации. С водородной деполяризацией металлы коррозируют с растворами H2S и СО2, которые являются слабыми кислотами. [9]
Дальнейшее смещение потенциала даже на 0 1 В в отрицательном направлении приводит к развитию процесса водородной деполяризации, и наблюдается щелочная коррозия алюминия. [10]
 |
Типичные зависимости коррозии от рН. [11] |
Исходя из рассмотренных ранее зависимостей, общее увеличение скорости коррозии в кислых средах следует объяснить ускорением процесса водородной деполяризации при одновременном протекании кислородной деполяризации. [12]
Наличие свободной углекислоты в воде также интенсифицирует протекание коррозионных процессов, а одновременное содержание в воде кислорода и углекислоты определяет параллельное протекание процессов кислородной и водородной деполяризации. [13]
С понижением значения рН, особенно при значительной общей кислотности почвы, ее коррозионная активность будет заметно возрастать, так как при этих условиях уже с заметной скоростью может протекать процесс водородной деполяризации. Ряд исследователей [14, 19] считают, что значения рН и общей кислотности могут служить достаточно надежным критерием коррозионной активности почвы. [14]
Так, термодинамически неустойчивый металл цинк ( VZn / Zn2 - 0 766В) достаточно устойчив в воде при обычной температуре ( 1 / На / н - 0 228В), поскольку процесс водородной деполяризации ( вытеснение водорода из воды) заторможен высоким перенапряжением выделения водорода на поверхности цинка. Термодинамически неустойчивые металлы А1 ( 1 / д / А13 - 1 66В; VrTI / T [ 3 - 1 63В; VZr / Zr3 - 1 53В) вполне устойчивы в воде при обычной температуре вследствие защитного действия тончайших пассивирующих окисных пленок, блокирующих их поверхность. Однако в тех средах, где нарушается сплошность этих пленок, все указанные металлы способны бурно корродировать с вытеснением водорода из воды, то есть реализуется термодинамическая возможность интенсивного коррозионного процесса с водородной деполяризацией. [15]
Страницы: 1 2 3