Процесс - водородная деполяризация
Cтраница 2
Поляризация вследствие замедленной диффузии молекулярного водорода носит название газовой концентрационной поляризации. Она сопровождает процесс водородной деполяризации, начиная с самых низких плотностей катодного тока. [16]
Анодные и катодные поляризационные кривые стали Х18Н10Т качественно отличаются от аналогичных кривых для углеродистой стали. При травлении стали Х18Н10Т процесс водородной деполяризации протекает очень вяло так как обратимый отрицательный потенциал водородного электрода больше по абсолютной величине стационарного потенциала стали в травильном растворе. [17]
Происходит при наличии в электролите кислорода, когда процесс водородной деполяризации затруднен. Такой механизм наблюдается при коррозионном воздействии на металл атмосферы воды, нейтральных растворов солей, а также в слабокислых средах при наличии кислорода. [18]
Происходит при наличии в электролите кислорода, когда процесс водородной деполяризации затруднен. Такой механизм наблюдается при коррозионном воздействии на металл воды, нейтральных растворов солей, атмосферы, а также в слабокислых средах при наличии кислорода. [19]
На отдельных участках металла в результате длительной избирательной коррозии может изменяться не только перенапряжение. В этих случаях процессы окислительной деполяризации могут сменяться процессами водородной деполяризации ( фиг. Таким образом, в зависимости от значений окислительно-восстановительного потенциала среды и от перенапряжений восстановления окислителя начальное ( положение и ход кривых катодной поляризации может изменяться в очень широких пределах. [20]
Перенапряжение водорода имеет большое значение в процессах коррозии металлов с водородной деполяризацией. Чем больше величина перенапряжения водорода на катодной составляющей сплава, тем медленнее протекает процесс водородной деполяризации, а следовательно, и коррозионный процесс. [21]
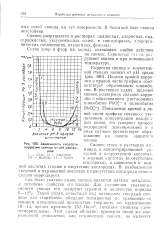 |
Зависимость скорости коррозии свинца от рН растворов. [22] |
Подъем кривой коррозии в правой части графика соответствует образованию плюмби-тов. Повышение кривой в левой части графика связано с увеличением концентрации водородных ионов, что ускоряет процесс водородной деполяризации н в ряде случаев препятствует образованию на свинце защитной: пленки. [23]
 |
SO. Зависимость скорости коррозии свинца от рН растворов. [24] |
Подъем кривой коррозии в правой части графика соответствует образованию плюмби-тов. Повышение кривой в левой части графика связано с увеличением концентрации водородных ионов, что ускоряет процесс водородной деполяризации и w о 8 W 12 ряде случаев препятствует обра-зованию на свинце защитной пленки. [25]
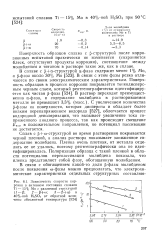 |
Зависимость скорости кор-розни в активном состоянии сплавов Ti - 15 % Мо с различной структурой ( J-P. 2 - р ш. 3 - р а в 40 % - ной H2SO4 от обратной вели-чины абсолютной температуры. [26] |
В связи с этим фазы резко отличаются по своим электрохимическим характеристикам. С увеличением количества р-фазы на поверхности, которая дисперсна и обладает более низким перенапряжением водорода [527], облегчается процесс водородной деполяризации, что вызывает увеличение тока сопряженного анодного процесса, так как происходит смещение Екор в положительном направлении, но потенциал пассивации не достигается. [27]
При гниении органических веществ образуются органические кислоты - гуминовая, муравьиная, уксусная и др, Высоким содержанием этих кислот и их солей отличаются болотистые почвы, в некоторых случаях - лесные. В таких почвах, особенно болотистых, значение рН может достигать 4 5, при котором на стали может протекать процесс водородной деполяризации. [28]
 |
Скорость коррозии меди в неокисляющих кислотах. [29] |
В горячей концентрированной соляной кислоте, однако, медь довольно легко растворяется и с выделением водорода. В этом случае образуются комплексные ионы меди ( СиС12) - и потенциал ее сильно разблагораживается, а благодаря высокой концентрации ионов водорода делается: возможным протекание процесса водородной деполяризации. Рассмотренные электрохимические характеристики и определяют характер стойкости меди и медных сплавов. Однако наличие окислителей, таких, как HNO3), Н2О2, или даже продувание кислорода или воздуха через, эти растворы, заметно повышает скорость коррозии меда и медных сплавов. [30]
Страницы: 1 2 3