Анодный катодный процесс
Cтраница 1
Анодные и катодные процессы локализуются на тех участках, где их протекание облегчено. [1]
Анодные и катодные процессы локализуются на тех участках, где их протекание облегчено. Причины, вызывающие электрохимическую неоднородность поверхности, весьма многочисленны: макро - и микронеоднородности металла; фазовая и структурная неоднородности металла; фазовая и структурная неоднородности сплавов; анизотропия кристаллитов; неоднородность и несплошность поверхностных пленок; неоднородность распределения деформаций и напряжений. Кроме того, неоднородны и жидкие фазы, контактирующие с поверхностью. [2]
Обычно анодные и катодные процессы развиваются на различных участках поверхности металла. Нередко удается определить площадь таких участков и их местонахождение. [3]
Пространственное разделение анодных и катодных процессов энергетически более выгодно, так как они локализованы на тех участках, где их прохождение облегчено. Гетерогенный механизм наблюдается при коррозии различных сплавов, для которых характерна электрохимическая неоднородность поверхности. [4]
При равномерной коррозии анодные и катодные процессы чаще всего не разделены и их нельзя связывать с каким-либо конкретным участком поверхности. Реакции, обусловливающие коррозионный процесс, статистически распределены в пространстве и во времени, и поэтому на гомогенной поверхности нет участков, где преимущественно протекают катодные или анодные реакции. [5]
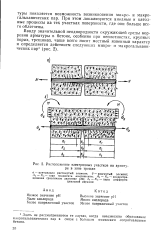 |
Расположение электродных участков на арматуре в зоне трещин. [6] |
При этом локализуются анодные и катодные процессы на тех участках поверхности, где они больше всего облегчены. [7]
Наиболее удобно рассматривать анодные и катодные процессы порознь и в плане излагаемого в этом разделе материала для первого из них ограничиться рассмотрением свободного роста новой фазы, или осадка, или такого роста, для которого взаимное перекрывание центров кристаллизации можно еще объяснить теоретически. [8]
Повышение температуры ускоряет анодные и катодные процессы, так как увеличивает скорость движения ионов, а, следовательно, и скорость коррозии. [9]
При гомогенно-электрохимическом механизме коррозии анодные и катодные процессы протекают на одном и том же участке, чередуясь по времени. Любом ЙеДанизме коррозии проявляется только на анодах; на катодных участках, где происходит процесс деполяризации, потерь металла не наблюдается. [10]
Присутствие ингибитора влияет на сложные анодные и катодные процессы, которые вызывают коррозию металлов, замедляют их окисление и снижают растворимость металлов в кислоте, но не влияют на растворимость окислов. Остальные соединения сурьмы практически не затрагиваются. Раствор соляной кислоты, содержащий перекись водорода, полностью переводит в раствор металлическую сурьму в тех же условиях. Четырехокись сурьмы в ходе анализа, остается в нерастворимом остатке. [11]
Разделение общей реакции коррозии на анодные и катодные процессы является следствием с одной стороны возможности существования ионов металла в растворе и свободных электронов в металле, а с другой стороны результатом большой легкости протекания реакции захвата из металлической решетки раздельно: иона металла гидрати-рующими, сольватирующими или комплексообразующими частицами раствора, а валентных электронов, остающихся в металле, окислителем-деполяризатором. Кроме того наличие ионной проводимости раствора позволяет анодным и катодным процессам в большей или меньшей степени ( в зависимости от условий) локализоваться на территориально-раздельных участках поверхности металла, где их протекание еще более облегчено и, следовательно, будет происходить с меньшей энергией активации. Это приводит к дальнейшему облегчению протекания коррозионного процесса. [12]
Гомогенная теория предполагает, что анодные и катодные процессы, происходящие на поверхности металла, не связаны с постоянными участками поверхности. На одном и том же участке возможно чередующееся во времени протекание катодного и анодного процессов. Для возникновения коррозии согласно этой теории достаточно, если металл находится при таком стационарном потенциале, чтобы были условия протекания двух сопряженных реакций: растворения металла и деполяризации. Изменение скорости одной из реакций влечет за собой общее изменение скорости коррозии. [13]
Устойчивое значение необратимого потенциала, наступающее при равенстве сумм скоростей анодных и катодных процессов, называется стационарным необратимым потенциалом. [14]
Для таких металлов, как медь и цинк, симметрия анодных и катодных процессов проявляется уже меньше. Их анодное растворение протекает обычно легче, чем катодное осаждение. Еще большая разница наблюдается в случае инертных металлов. Тем не менее она и здесь достигает нескольких десятых долей вольта и значительно превосходит анодную поляризацию, сопровождающую растворение промежуточных и нормальных металлов. Ряд металлов, составленный в порядке возрастания металлического перенапряжения ( см. табл. 46), отражает, таким образом, и последовательность увеличения поляризации при их анодном растворении. [15]
Страницы: 1 2 3 4