Анодный катодный процесс
Cтраница 2
Для таких металлов, как медь и цинк, симметрия анодных и катодных процессов проявляется уже в меньшей степени. Их анодное растворение протекает обычно легче, чем катодное осаждение. [16]
Для таких металлов, как медь и цинк, симметрия анодных и катодных процессов проявляется уже в меньшей степени. Их анодное растворение протекает легче, чем катодное осаждение. [17]
Электродный потенциал стали в грунте характеризует положение равновесия между скоростями электрохимических анодных и катодных процессов, протекающих на поверхности металла. [18]
Наличие электронной проводимости металла и ионной проводимости раствора позволяет протекать анодным и катодным процессам территориально раздельно - на различных участках металла. Это условие не обязательно для протекания электрохимического процесса, так как в некоторых условиях коррозии катодные и анодные процессы могут протекать на одной и той же поверхности, чередуясь во времени. Однако пространственное разделение анодной и катодной реакции оказывается энергетически более выгодным, так как анодные и катодные реакции могут локализоваться на тех участках, где их протекание будет более облегчено. [19]
Кинетика процесса определяется рядом факторов, влияющих на протекание и скорость анодных и катодных процессов и соответственно отражающихся на изменениях силы тока и потенциалов в этих процессах. [20]
Для таких металлов, - как медь и цинк, симметрия анодных и катодных процессов проявляется уже в меньшей степени. Их анодное растворение протекает легче, чем катодное осаждение. [21]
При 100 С в 40 % - ной серной кислоте торможение анодных и катодных процессов на рении ( см. рис. 3, кривые 4) значительно меньше, чем при 25 С. [22]
Кинетика процесса определяется рядом факторов, влияющих на протекание и скорость анодных и катодных процессов и соответственно отражающихся на изменениях силы тока и потенциалов в этих процессах. Самым важным фактором является поляризация - изменение значений начальных потенциалов электродов ( анода и катода) при замыкании цепи в коррозионном элементе. [23]
Влажность среды существенным образом влияет на скорость коррозии, воздействуя как на анодный и катодный процесс, так и на изменение омического сопротивления, а структурная неоднородность вызывает появление микро-и макрокоррозионных элементов на поверхности металла. [24]
Наличие электронной проводимости у металла и ионной проводимости у раствора электролита позволяет анодным и катодным процессам протекать раздельно на различных участках поверхности металла. [25]
Стационарным потенциалом называется постоянный во времени неравновесный потенциал, при котором суммы скоростей анодных и катодных процессов, протекающих на одной поверхности ( растворение и выделение обоих металлов), равны. Выделение микрокомпонента при этом происходит, но очень медленно. [26]
Таким образом при электрохимической коррозии на корродирующей поверхности предусматривается стабильная или перемежающаяся локализация анодных и катодных процессов. [27]
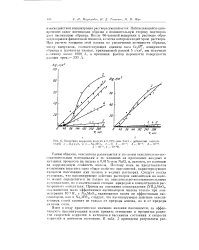 |
Кинетика коррозии железа в 0 01 % - ном NaCl с добавками окислителей а - К Г г2Ог и и - Na.. W04. i - 0. 2 - Ю-5. 3 - 10 - 4. 4 - Ю-3. [28] |
Таким образом, окислители различаются и по своим окислительно-восстановительным потенциалам и по влиянию на протекание анодных и катодных процессов на железе в 0 01 % - ном NaCI, и, наконец, по влиянию на коррозионную стойкость железа. Поэтому пока не представляется возможным выделить одно общее свойство окислителей, характеризующее процессы пассивации ими железа в водных растворах. Следует всегда учитывать, что пассивирующее действие растворов окислителей на железо может определяться не только их окислительно-восстановительными потенциалами, но в значительной степени природой и концентрацией растворенного окислителя. Причем на основании сопоставления ( NH4) 2Mo04, оказавшегося мало эффективным пассиватором железа только при концентрации 10 - 3М, с Na2Mo04, являющимся таким же эффективным пассиватором, как и Na2W04, следует, что пассивирующее действие окислительных солей зависит не только от природы аниона, но и от природы катиона соли. [29]
Наличие электронной проводимости у стали и ионной проводимости у пластовых вод ( электроплита) позволяет анодным и катодным процессам протекать на различных участках поверхности стали или на одних и тех же участках, чередуясь во времени. Вследствие малого омического сопротивления пластовых вод в системах нефть - газ - вода наблюдается высокая активность не только микрогальванических коррозионных элементов ( возникающих от наличия структурных включений в металле), но и коррозионных макропар, образующихся на поверхности труб из-за неодинаковой доставки деполяризаторов. [30]
Страницы: 1 2 3 4