Конротаторный процесс
Cтраница 1
Конротаторный процесс неблагоприятен, так как продукт такой реакции будет содержать гранс-двойную связь в семичленном кольце и его энергия будет очень высока. Поэтому реакция протекает только в более жестких условиях, возможно через бирадикальный интермедиат. [1]
Днализ конротаторного процесса проводится точно таким же образом. [3]
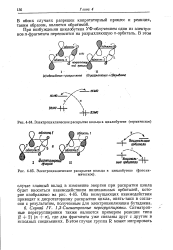 |
Электроциклическое раскрытие кольца в циклобутене ( термическое область Т Ш область 1 -.| Электроциклическое раскрытие кольца в циклобутене ( фотохи. [4] |
В обоих случаях разрешен конротаторный процесс и реакция, таким образом, является обратимой. [5]
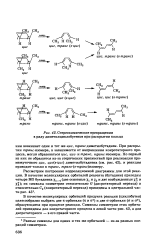 |
Стерео-химические превращения в ряду диметилциклобутенов при раскрытии кольца. [6] |
При раскрытии транс-изомера, в зависимости от направления конротаторного процесса, могли образоваться цис, цис - и транс, транс-изомеры. Но первый из них не образуется из-за стерических препятствий при реализации промежуточного цис, цис ( з-цис) диметилбутадиена ( см. рис. 42), и реакция приводит только к транс, транс - ( 8-транс) изомеру. [7]
Обратная реакция циклизации бутадиенов в циклобутешл также должна быть конротаторным процессом; но поскольку изменение свободной энергии этой реакции обычно неблагоприятно, то известно очень мало примеров такой обратной реакции. [8]
Нетрудно видеть, что, какую бы формальную схему мы ни приняли, конротаторный процесс разрешен по симметрии. [9]
Если раскрытие циклопропанового кольца происходит одновременно с потерей уходящей группы, то тогда возможны два различных дисротаторных и один конротаторный процесс. [10]
Наоборот, при фотохимическом процессе переход из первого возбужденного состояния циклобутеьа в первое возбужденное состояние цис-бутадиена) энергетический барьер имеет конротаторный процесс. [11]
Превращение лентадяенильного катиона в циклопентенильный является электроциклической реакцией в системе, содержащей 4п - электрона, де-локализованных на пяти атомных орбиталях, и поэтому должно быть конротаторным процессом, Б только что описанном примере стереохимия реакции циклизации маскируется последующей перегруппировкой алкильных групп, которая в конечном счете приводят к Наиболее устойчивому карбениевоку иову. [12]
При УФ облучении электрон переходит на НСМО, ее симметрия - ( ВЗМО) - начинает определять возможность циклизации; связывание концевых л - АО достигается только в конротаторном процессе, что однозначно ведет к цис-изомеру. [13]
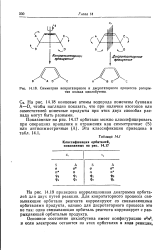 |
Симметрии конротаторного и дисротаторного процессов раскрытия кольца циклобутена. [14] |
На рис. 14.19 приведена корреляционная диаграмма орбита-лей для двух путей реакции. Для конротаторного процесса связывающие орбитали реагента коррелируют со связывающими орбиталями продукта, однако для дисротаторного процесса это не так: одна связывающая орбиталь реагента коррелирует с разрыхляющей орбиталью продукта. [15]
Страницы: 1 2 3
