Прочность - молекула
Cтраница 3
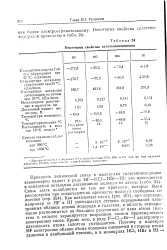 |
Некоторые свойства галегеноводородов. [31] |
Связь здесь ослабляется по тем же причинам, которые были рассмотрены при сопоставлении прочности молекул свободных галогенов ( стр. Как показывает схема ( рис. 107), при переходе, например от HF к HI уменьшается степень перекрывания электронных облаков атомов водорода и галогена, а область перекрывания располагается на большем расстоянии от ядра атома галогена и сильнее экранируется возросшим числом промежуточных электронных слоев. Кроме того, в ряду F - С1 - Вг-I электроотрн-цателыюсть атома галогена уменьшается. [32]
Связь здесь ослабляется по тем же причинам, которые были рассмотрены при сопоставлении прочности молекул свободных галогенов ( стр. Как показывает схема ( рис. 107), при переходе, например, от HF к HI уменьшается степень перекрывания электронных облаков атомов водорода и галогена, а область перекрывания располагается на большем расстоянии от ядра атома галогена и сильнее экранируется возросшим числом промежуточных электронных слоев. Кроме того, в ряду F - С1 - Вг-I электроотрицательность атома галогена уменьшается. Поэтому в молекуле HF электронное облако атома водорода смещается в сторону атома галогена в наибольшей степени, а в молекулах НС1, НВг и HI - все меньше и меньше. Это также приводит к уменьшению перекрывания взаимодействующих электронных облаков и, тем самым, к ослаблению связи между атомами. [33]
 |
Схема перекрывания электронных облаков при образовании молекул HF и HI. [34] |
Связь здесь ослабляется по тем же причинам, которые были рассмотрены при сопоставлении прочности молекул свободных галогенов ( стр. Как показывает схема ( рис. 107), при переходе, например, от HF к HI уменьшается степень перекрывания электронных облаков атомов водорода и галогена, а область перекрывания располагается на большем расстоянии от ядра атома галогена и сильнее экранируется возросшим числом промежуточных электронных слоев. Кроме того, в ряду F - С1 - Вг - I электроотрицательность атома галогена уменьшается. Поэтому в молекуле HF электронное облако атома водорода смещается в сторону атома галогена в наибольшей степени, а в молекулах НС1, НВг и HI - все меньше и меньше. Это также приводит к уменьшению перекрывания взаимодействующих электронных облаков и, тем самым, к ослаблению связи между атомами. [35]
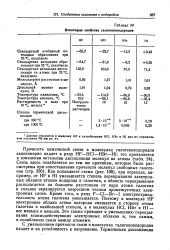 |
Некоторые свойства галогеноводородов. [36] |
Связь здесь ослабляется по тем же причинам, которые были рассмотрены при сопоставлении прочности молекул свободных галогенов ( стр. Как показывает схема ( рис. 108), при переходе, например, от HF к HI уменьшается степень перекрывания электронных облаков атомов водорода и галогена, а область перекрывания располагается на большем расстоянии от ядра атома галогена и сильнее экранируется возросшим числом промежуточных электронных слоев. Кроме того, в ряду F - С1 - Вг-I электроотрицательность атома галогена уменьшается. Поэтому в молекуле HF электронное облако атома водорода смещается в сторону атома галогена в наибольшей степени, а в молекулах HCI, НВг и HI - все меньше и меньше. Это также приводит к уменьшению перекрывания взаимодействующих электронных облаков и, тем самым, к ослаблению связи между атомами. [37]
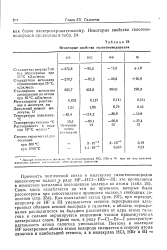 |
Некоторые свойства галогеноводородов. [38] |
Связь здесь ослабляется по тем же причинам, которые были рассмотрены при сопоставлении прочности молекул свободных галогенов ( стр. Как показывает схема ( рис. 107), при переходе, например от HF к HI уменьшается степень перекрывания электронных облаков атомов водорода и галогена, а область перекрывания располагается на большем расстоянии от ядра атома галогена и сильнее экранируется возросшим числом промежуточных электронных слоев. Кроме того, в ряду F - С1 - Вг-I электроотрн - - цательность атома галогена уменьшается. [39]
 |
Дативная я-связь. [40] |
Все это говорит о том, что в молекулах карбонилов должна иметься дополнительная связь Me-С, увеличивающая прочность молекулы в целом. Она образуется за счет перекрывания заполненных d - орби-талей атома металла, не участвующих в о-связях, с подходящими орбиталями ли-гандов. Такими подходящими орбиталями могут быть свободные разрыхляющие п-орбитали окиси углерода. В отличие от 0-связи, донором здесь является атом металла, поставляющий свои d - электроны на свободные орбитали лиганда. Такая связь называется дативной п-связью. На рис. 3 показано перекрывание d - орбиталей металла с я-орбиталями СО. [41]
 |
Схематическое изображение строения молекулы дивинила. [42] |
Переход от молекул с изолированной системой связей к молекулам с системой сопряженных связей сопровождается уменьшением энергии, увеличением прочности молекулы. [43]
Молекула тринитробензола, следовательно, является наиболее устойчивой по отношению к удару; введение метильной группы ( тринитротолуол) уменьшает прочность молекулы; поэтому энергия, необходимая для разрушения молекулы тринитротолуола, меньше, чем для тринитробензола. [44]
При еще более высоких молекулярных массах ( Mu2-105 г / моль) и при постоянной нагрузке прочность фибриллы, по-видимому, в большей степени определяется прочностью молекул, а не их перемещением. При воздействии переменных нагрузок распутывание может происходить даже при этих значениях молекулярной массы. Результаты недавно проведенных экспериментов Скибо, Херцберга и Мансона [191] убедительно подтверждают, что разрыв молекулярных нитей происходит вследствие того, что их распутывание приводит к ступенчатому росту усталостных трещин. Это явление более детально будет рассмотрено в разд. [45]
Страницы: 1 2 3 4