Прочность - связывание
Cтраница 2
К понятиям, характеризующим прочность связывания газа, относятся упругости десорбции и разложения образующихся соединений, устойчивость их под действием электронной бомбардировки, величина истинного равновесного давления и тепловые эффекты, связанные с поглощением. [16]
При сроке хранения до года прочность связывания составляет 35 - 40 % от первоначальной. [17]
Они значительно различаются между собой по прочности связывания с мембраной. Чтобы их выделить, требуется, как правило, предварительно разрушить мембрану с помощью ПАВ или орг. [18]
Показаны влияние различных технологических и конструктивных факторов на интенсивность и прочность связывания тканей в единое целое внешним давлением, возможность переработки мясной обрези, формование из нее монолитных кусков сырья прессованием. Показана перспективность формования продуктов с заданными питательными свойствами из кусочков различного сырья. [19]
Превращение основного состояния фермент-субстратного комплекса в переходное ведет к увеличению прочности связывания фермента с субстратом ( точнее, измененных или активированных фермента и субстрата) и к уменьшению активационного барьера реакции. При этом в согласии с основными положениями теории переходного состояния уменьшение свободной энергии активации соответствующей стадии ферментативной реакции определяется разницей свободных энергий реального и гипотетического фермент-субстратного комплекса. Следовательно, если напряжения или деформации, существующие в фермент-субстратном комплексе, снимаются в переходном состоянии реакции, то они выгодны для фермента на стадии каталитического превращения комплекса. Чем более выражены такие напряжения в фермент-субстратном комплексе, тем выше каталитическая константа ферментативной реакции. [20]
Расщепление рацематов хроматографией на диссимметрических стационарных фазах происходит благодаря различию в прочности связывания сорбентом разделяемых антиподов. [21]
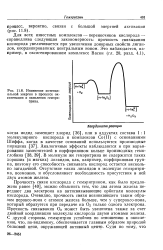 |
Изменение потенциальной энергии в процессе ок-сигенации и окисления гемэри-трина. [22] |
Для всех известных комплексов - переносчиков кислорода - справедлива следующая закономерность: прочность связывания кислорода увеличивается при увеличении донорных свойств лигандов, координированных центральным ионом. Это наблюдается, например, в оксигенированном комплексе Васки ( гл. [23]
Для слабых ионообменников выбор рН буфера определяет степень ионизации их ионогошшх групп, которая влияет на прочность связывания вещества прежде всего через изменение плотности распределения зарядов по объему сорбента и соответственное изменение возможностей многоточечной сорбции. Кроме того, и сами процессы нейтрализации или ионизации ионогениых групп сорбента при сдвигах рН буфера соответственно затрудняют или способствуют взаимодействию вещества с обменником. С другой стороны, рН буфера определяет знак и среднее значение суммарного электрического заряда молекул вещества, полноту ионизации его ионогенных групп, число и характер распределения зарядов обоих знаков на поверхности молекул амфолитов. [24]
Этот переход сопровождается также изменением целого ряда свойств фермента, в частности энергии активации реакции и изменения прочности связывания с низкомолекулярными фрагментами субстратов. В этих условиях кристаллизуется ( в орторомбической форме) исключительно один фермент без моносахарида. Кристаллизация лизоцима с хитобиозой несколько отличалась по характеру, и соответствующий комплекс ( в тетрагональной форме) образовывался при температуре кристаллизации от 20 до 40 С, но при 50 С образовывались только орторомбические кристаллы, не содержащие хитобиозу. [25]
 |
Константы ассоциации Kt, М 1, замещенных бензолов с активным центром фермента и их зависимость от коэффициентов распределения Р втих соединений в системе вода - октанол. [26] |
Однако этой концепции явно противоречит то, что полярные группы в молекуле ингибитора не оказывают практически никакого влияния на прочность связывания его с хи-мотрипсином. [27]
Тем самым в переходном состоянии достигается комплементарность активного центра и субстрата ( вернее их измененных структур), возрастает прочность связывания за счет дополнительного фермент-субстратного взаимодействия, а следовательно, и скорость ферментативного катализа. [28]
 |
Образец для испытаний с помощью конусов. [29] |
Отметим, что распространенная интерпретация испытаний связи, где разрушение внутри резины трактуется как указание на то, что прочность связывания резины с металлом превосходит прочность резины, может быть верна, только если методика испытаний позволила одинаково нагрузить резину и границу связывания. [30]
Страницы: 1 2 3 4