Прочность - комплексное соединение
Cтраница 2
Таким образом, прочность комплексных соединений данного металла меняется при переходе от аддендов одного типа к аддендам другого рода. [16]
В случае хлористого цезия прочность комплексного соединения CsPbCls значительно больше. Естественно, что комплексообразование макрокомпонента в этой системе проявляется резче, что и подтверждает большая величина коэффициента кристаллизации во всех изученных интервалах температур и составов расплава. [17]
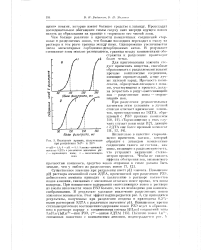 |
Выходные кривые, полученные при разделении Nd3 и Рг3. [18] |
Чем больше различие в прочности комплексных соединений тормоза и разделяемых ионов, тем больше последних переходит в смолу из раствора и тем резче граница между ними. Одновременно увеличивается число элементарных сорбционно-десорбционных актов. В результате смешанные зоны меньше размываются, границы между компонентами обостряются и разделение происходит более четко. [19]
Согласно [ 13 - 15J, прочность комплексных соединений зависит от природы катиона внешней сферы из-за его контрпо-ляризующего действия на комплексный анион. Поэтому введение в растворы катионов высокой поляризующей способности вызывает понижение скорости коррозии вследствие снижения прочности образующегося при травлении меди комплексного иона CuCl, что приводит к увеличению активности ионов Cu ( I) в приэлектродном слое. [20]
Известно, что наиболее объективной характеристикой прочности комплексных соединений являются константы их нестойкости. Однако эти величины в большинстве случаев неизвестны. Несмотря на то, что в последнее время получено много данных о константах нестойкости комплексов [17], тем не менее практическое применение комплексов растет значительно быстрее, чем их физико-химическое изучение. Поэтому часто нужен, хотя и приближенный, но быстрый метод сравнения прочности комплексов, который мог бы охватить широкий круг комплексообразо-вателей. Быстрым и удобным методом оценки прочности комплексных соединений является металл-индикаторный метод. В некоторой степени он аналогичен методам определения рН с помощью цветных кислотно-основных индикаторов. [21]
Величина окислительного потенциала находится в прямой зависимости от прочности комплексных соединений, образующихся в растворах окислительно-восстановительных систем. Смещение уровня окислительного потенциала, вызванное комплексообразова-нием, может стабилизировать состояние окисления центрального иона. В водных растворах катионы переходных металлов находятся в тех степенях окисления, которые устойчивы в аквакомплексе. Взаимодействие катиона с молекулами воды обусловлено соотношением между окислительными потенциалами систем Н - Н2 или О2 - ОН и системы, включающей катион переходного металла. Известно, что аквакомплекс Со ( III) неустойчив в водных растворах. [22]
Экстракция солей металлокислот характеризуется удовлетворительной селективностью и зависит от прочности комплексного соединения, диэлектрической проницаемости экстра-гейта, основности и стерической доступности его электронодо-норных функциональных групп и других факторов. Рассматриваемые элементы имеют средние и высокие потенциалы возбуждения, их атомы в низкотемпературных пламенах, например в пламени пропан - воздух, не возбуждаются. [23]
Сульфирующая способность соединений типа RgN SO3 уменьшается с увеличением прочности комплексного соединения. Таким образом, наименее активными сульфирующими агентами являются соединения алифатических аминов. [24]
Сульфирующая способность соединений типа R3N 5Оз уменьшается с увеличением прочности комплексного соединения. Таким образом, наименее активными сульфирующими агентами являются соединения алифатических аминов. [25]
С увеличением ионного радиуса щелочного металла должна увеличиваться также и прочность комплексных соединений SrCl2, что должно приводить к уменьшению активности ионов микрокомпонента в расплаве и к уменьшению значения коэффициента кристаллизации. Однако проведенные исследования показали, что с увеличением ионного радиуса катиона растворителя наблюдается систематическое увеличение коэффициента кристаллизации микрокомпонента. [26]
Правило Пирсона следует рассматривать как удобный принцип для качественной оценки отжэашуиэной прочности комплексных соединений, имеющих один и тот же центральный атом и различнне-ли-ганды, и, наоборот, комплексных соединений, имеющих одинаковые лиганды, но различные центральные атомы. [27]
Таким образом, расчет показывает, что в результате образования одного хелатного цикла прочность комплексного соединения возрастает в 282 раза. [28]
Метод ионообменной хроматографии получает в последнее время все большее распространений для изучения состава и прочности комплексных соединений. [29]
В середине 1930 - х годов благодаря усовершенствованию методов и приемов исследования строения и прочности комплексных соединений появились первые данные, подтверждающие предположение Черняева. Так, изучение молекулярной электропроводности некоторых комплексных соединений палладия, проведенное в 1935 г. А. А. Гринбергом совместно с В. М. Шульманом и С. И. Хорунженковым 102 ], позволило объяснить механизм изомеризации палладодиаминов на базе закономерности трансвлияния. [30]
Страницы: 1 2 3 4