Дивинилкетон
Cтраница 1
Дивинилкетоны были исследованы полярографически [ Па, 53 ], однако их гидродимеризация в отсутствие кисчоты полностью не была объяснена. [1]
Дивинилкетоны могут служить исходными веществами для дальнейших синтезов ряда циклических и гетероциклических соединений, вплоть до сложнейших природных соединений, близких к стероидам и алкалоидам. [2]
Дивинилкетоны могут служить исходными веществами для дальнейших синтезов ряда циклических и гетероциклических соединений. [3]
Дивинилкетоны желтые жидкости слезоточивого действия-по-лимеризуются при хранении и склонны к различным реакциям присоединения. [4]
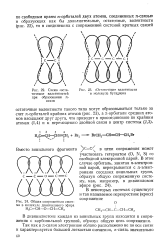 |
Схема остаточных валентностей при образовании л-связи.| Остаточные валентности в молекуле бутадиена.| Общая сопряженная система в молекуле дивннилового эфира Н2ССН - 0 - СНСН2. [5] |
В дивинилкетоне каждая из винильных групп находится в сопряжении с карбонильной группой, образуя общую цепь сопряжения. [6]
С) дивинилкетонов ( их получают гидратацией днвинилацетиле-новых углеводородов или др. способами) с Н3РО4, Н28О4, НС1 или др. к-той - Получение циклопентенонов с геминаль-ными заместителями требует более жестких условий. [7]
Недостаток применения дивинилкетона СН2 СНСОСНСН2 в реакциях аннелирования состоит в том, что наряду с диалкилированием происходит моноалкилировамие. Вместо дивинилкетона можно с успехом применять X. Например, натриевая соль дикетона ( 1) гладко реагирует с X. Последовательность реакций включает двукратную циклодегидратацию, расщепление сложного эфира и декарбоксили-рование р-кетокислоты. [8]
При циклизации дивинилкетонов под влиянием фосфорной кислоты при температуре 19 - 20 наряду с ци-клопентенонами образуются а-циклопентанолоны. [9]
При гидрировании дивинилкетона [7] в присутствии Pt-катализатора ( по Адамсу) получается лишь диэтилкетон. При гидрировании 1-метокси-пентен - 4-она - 3 получается соответствующий предельный кетон. [10]
Недостаток применения дивинилкетона СН2 СНСОСНСН2 в реакциях аннелирования состоит в том, что наряду с диалкилированием происходит моноалкилировамие. Вместо дивинилкетона можно с успехом применять X. Например, натриевая соль дикетона ( 1) гладко реагирует с X. Последовательность реакций включает двукратную циклодегидратацию, расщепление сложного эфира и декарбоксили-рование р-кетокислоты. [11]
Если гидрирование р-замещенных дивинилкетонов прервать на стадии поглощения 1 моля HZ, то главным продуктом реакции будут р-замещенные винилкетоны; имеются также небольшие количества предельных кетонов. Первый моль Н2 присоединяется к ( 3, ( З - диалкил-винилкетонам преимущественно по незамещенной винильной группе и лишь незначительно идет параллельное гидрирование ( 3, р - диалкилви-нильной группы. [12]
Образующиеся при этом дивинилкетоны способны к целому ряду интереснейших превращений и могут служить прекрасными исходными продуктами для синтеза производных гидрированных шестичлешшх гетероциклических соединений. [13]
Во избежание полимеризации дивинилкетонов, изомеризацию целесообразно вести в спиртовых растворах. В этих условиях вторичные винил-этинилкарбинолы дают предельные диалкоксикетоны, а третичные - непредельные моноалкоксикетоны, так как присоединение второй молекулы спи рта к дизамещеннои винильной группе идет с трудом. [14]
Присоединение спиртов к дивинилкетонам протекает тем медленнее, чем больше молекулярный вес спирта и степень разветвления спиртового радикала. [15]
Страницы: 1 2 3 4