Дигалид
Cтраница 1
Дигалиды СоНа12 также образуются при взаимодействии простых веществ или обезвоживанием соответствующих кристаллогидратов. Дигалиды ( кроме CoF2) растворимы в воде. Гидроксид Со ( ОН) 2 существует в виде синей и розовой модификаций. Синяя модификация получается при действии щелочей на соли Со ( II) на холоду; при нагревании Со ( ОН) 2 переходит в розовую модификацию. В воде Со ( ОН) 2 не растворяется. По химической природе он, как и СоО, - амфотерное соединение, преимущественно проявляющее основные свойства. [1]
Дигалиды проявляют восстановительные свойства, а три-галиды - довольно сильные окислители. [2]
Дигалиды СоНа12 также образуются при взаимодействии простых веществ или обезвоживанием соответствующих кристаллогидратов. Дигалиды ( кроме CoF2) растворимы в воде. Гидроксид Со ( ОН) 2 существует в виде синей и розовой модификаций. Синяя модификация получается при действии щелочей на соли Со ( II) на холоду; при нагревании Со ( ОН) 2 переходит в розовую модификацию. В воде Со ( ОН) 2 не растворяется. По химической природе он как и СоО, - амфотерное соединение, преимущественно проявляющее основные свойства. [3]
Дигалиды СоНа12 также образуются при взаимодействии простых веществ или обезвоживанием соответствующих кристаллогидратов. Дигалиды ( кроме CoF2) растворимы в воде. Гидроксид Со ( ОН) 2 существует в виде синей и розовой модификаций. Синяя модификация получается при действии щелочей на соли Со ( II) на холоду; при нагревании Со ( ОН) 2 переходит в розовую модификацию. В воде Со ( ОН) 2 не растворяется. По химической природе он, как и СоО, - амфотерное соединение, преимущественно проявляющее основные свойства. [4]
Дигалиды и тригалиды этих элементов способны при диссоциации к образованию Э2 и Э3, обладающих сильными восстановительными свойствами. [5]
Дигалиды проявляют восстановительные свойства, а три-галиды - довольно сильные окислители. [6]
Дигалиды Мо и W в отличие от дигалидов Сг относятся к кластерным соединениям. Кластерные галиды характерны для 4d - и Sd-элементов V-VI11 групп, но не характерны для Зс. Характерная для 4d - и Sd-элементов тенденция к использованию при образовании химической связи всех своих валентных электронов обычно осуществляется за счет перехода их в высшую степень окисления. [7]
Дигалиды олова и, особенно, германия обладают также восстановительными свойствами. [8]
Известны дигалиды, сульфиды ( MnS, MnS2), нитриды ( Mn2N, Mn3N2 и др.), карбиды ( Мп3С, Мп4С и др.), силициды ( MnSi, Mn3Si и др.) марганца. [9]
Для дигалидов характерны сильные восстановительные свойства, в связи с чем они крайне неустойчивы. Тригалиды титана хотя и являются настоящими солями, но способны частично подвергаться гидролизу при растворении в воде. Тетрагалиды титана, образующиеся при непосредственном взаимодействии титана с соответствующими галогенами, представляют собой соединения ковалентнон природы. Так, в жидком состоянии они не проводят электрический ток, а при взаимодействии с водой не диссоциируют, а напело гидроли-зуются. Водородом и металлами тетрагалиды титана восстанавливаются, причем в зависимости от условий восстановление может происходить до образования тригалидов, дигалидов и даже элементарного титана. [10]
 |
Свойства дигалидов никеля. [11] |
С водой дигалиды никеля образуют аквасоединения, представляющие собой кристаллы зеленого цвета. Все галиды хорошо растворимы в воде и подвергаются в растворе гидролизу. [12]
Тригалиды ( MeF3) и дигалиды ( МеГ2) менее устойчивы. [13]
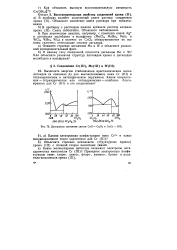 |
Диаграммы состояния систем СаО - Сг2О3 и СггОз - SiO2. [14] |
К какому типу соединений относятся дигалиды Мо и W. [15]
Страницы: 1 2 3 4