Дигалид
Cтраница 2
Из галидов олова и свинца известны дигалиды и РЬГ2 и тетрагалиды 8пГ4 и PblY Дигалиды олова и свинца являются настоящими солями, хотя им свойственны реакции, приводящие к образованию комплексных анионов [ 5пГ4 ] 2 - и [ РЬГ4 ] 2 - Дигалиды олова обладают также восстановительными свойствами, причем дихлорид олова часто используется в качестве восстановителя. Тетрагалиды олова и свинца по физическим свойствам и химическому характеру следует рассматривать не как соли, а как соединения ковалентной природы - кислотообразователи. Так, например, тетрахлориды представляют собой довольно летучие жидкости, не проводящие электрического тока. При взаимодействии с водой они подвергаются не электролитической диссоциации, а гидролизу. [16]
Тригалиды Т ( Гз и особенно дигалиды Т1Г2 менее устойчивы. Галиды титана в различной степени окисления обладают различными свойствами. [17]
Дигалиды Мо и W в отличие от дигалидов Сг относятся к кластерным соединениям. Кластерные галиды характерны для 4d - и Sd-элементов V-VI11 групп, но не характерны для Зс. Характерная для 4d - и Sd-элементов тенденция к использованию при образовании химической связи всех своих валентных электронов обычно осуществляется за счет перехода их в высшую степень окисления. [18]
С галогенами железо образует тригалиды ( кроме иода) и дигалиды со всеми галогенами; кобальт и никель образуют только дигалиды. [19]
Из галидов германия, олова и свинца известны тетрагали-ды МеГ4 и дигалиды МеГ2, из которых более устойчивыми являются тетрага1 лиды германия и олова и дигалиды свинца. Так, например, тетрахлориды представляют собой сравнительно летучие жидкости, не проводящие электрического тока. [20]
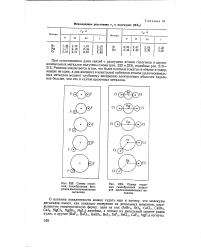 |
Схемы строения. газообразных фторидов щелочноземельных металлов. [21] |
О влиянии ковалентности можно судить еще и потому, что молекулы дигалидов имеют, как показало измерение их дипольных моментов, определенную геометрическую форму: одни из них ( SrBr2, SrI2, СаС12, СаВг2, CaI2, MgCl2, MgBr2, MgI2) линейны, а потому их дипольный момент равен нулю, а другие ( BaF2, ВаС12, BaBr2, BaI2, SrF2, SrCl2, CaF2, MgF2) согнуты. [22]
При химическом анализе, например, с помощью ионов Ag в дигалидах молибдена и вольфрама ( МоС12, МоВг2, Мо12 и WC12, WBr2, WI2) в отличие от СгС12 обнаруживаются не все ионы галогена, отвечающие составу дигалида. [23]
С галогенами никель взаимодействует при высоких температура: -: с образованием дигалидов. На воздухе при обычных температурах никель устойчив, а при высоких температурах раскаленный никель сгорает с образованием диоксида. С серой порошкообразный никель при нагревании соединяется, образуя моносульфид. С азотом никель непосредственно не соединяется. С фосфором соединяется с выделением теплоты и образованием фосфидов. [24]
Из галидов олова и свинца известны дигалиды и РЬГ2 и тетрагалиды 8пГ4 и PblY Дигалиды олова и свинца являются настоящими солями, хотя им свойственны реакции, приводящие к образованию комплексных анионов [ 5пГ4 ] 2 - и [ РЬГ4 ] 2 - Дигалиды олова обладают также восстановительными свойствами, причем дихлорид олова часто используется в качестве восстановителя. Тетрагалиды олова и свинца по физическим свойствам и химическому характеру следует рассматривать не как соли, а как соединения ковалентной природы - кислотообразователи. Так, например, тетрахлориды представляют собой довольно летучие жидкости, не проводящие электрического тока. При взаимодействии с водой они подвергаются не электролитической диссоциации, а гидролизу. [25]
Из галидов германия известны устойчивые тгтрагалиды ОеГ4 и неустойчивые, обладающие сильными восстановительными свойствами дигалиды GelY Тетрагалиды германия по физическим свойствам и химическому характеру являются типичными кислотообразователями-соединениями с ковалентны-ми связями. [26]
Из соединений марганца с галогенами устойчивы только дига-лиды МпГ2, а остальные его галиды легко разлагаются на дигалид и свободный галоген. [27]
С галогенами железо образует тригалиды ( кроме иода) и дигалиды со всеми галогенами; кобальт и никель образуют только дигалиды. [28]
Из галидов германия, олова и свинца известны тетрагали-ды МеГ4 и дигалиды МеГ2, из которых более устойчивыми являются тетрага1 лиды германия и олова и дигалиды свинца. Так, например, тетрахлориды представляют собой сравнительно летучие жидкости, не проводящие электрического тока. [29]
При химическом анализе, например, с помощью ионов Ag в дигалидах молибдена и вольфрама ( МоС12, МоВг2, Мо12 и WC12, WBr2, WI2) в отличие от СгС12 обнаруживаются не все ионы галогена, отвечающие составу дигалида. [30]
Страницы: 1 2 3 4