Пятиокись - ниобий
Cтраница 1
Пятиокись ниобия часто бывает загрязнена пятиокисью тантала, а иногда и двуокисью титана. [1]
Пятиокись ниобия ( 0 1000 г) растворяют в 20 мл серной кислоты и 2 г аммония сернокислого при нагревании и перемешивании. Раствор охлаждают, переносят в мерную колбу на 200 мл и доводят до метки серной кислотой. В мерные колбы на 50 мл отбирают 5; 7 5; 10; 12 5; 15; 17 5; 20 мл полученного раствора, что соответствует 2.50; 3 75; 5 00; 6 25; 7 50; 8 75; 10 мг пятиокиси ниобия; добавляют 0, 5 мл 33 % - ной перекиси водорода и доводят до метки серной кислотой. [2]
Пятиокись ниобия, полученная из гидроокиси, - белый порошок. [3]
Пятиокись ниобия, раствор, содержащий 1 мг NbzOs в 1 мл. Сплавляют 0 13 г № 265 с 2 г пиросульфата калия, плав растворяют в 100 мл нагретого до кипения 0 1 М раствора винной кислоты. [4]
Пятиокись ниобия имеет псевдогексагональную ромбическую кристаллическую структуру; параметры решетки а 6 1В 0 03 А, Ь 3 65 J - 0 02 А и с 3 94 0 02 А. [5]
Пятиокись ниобия восстанавливается водородом при нагревании с образованием Nb02, Nb203, NbO или металлического ниобия. [6]
Пятиокись ниобия значительно более слабый катализатор окисления, чем пятиокись ванадия. [7]
Пятиокись ниобия плохо растворима в кислотах; низшие окислы легче поддаются их действию. [8]
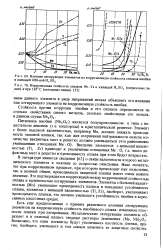
Пятиокись ниобия a - Nb2O5 состава, близкого к стехиометриче-скому, имеет положительный температурный коэффициент удельной проводимости. Исследована в интервале 300 - 900 С при постоянном давлении кислорода. Термическая ширина запрещенной зоны равна 1 65 эв. По механизму проводимости сходна с двуокисью титана. [9]
Пятиокись ниобия ( Nb20s) является полупроводником я типа с недостатком анионов ( т.е. кислорода) в кристаллической решетке. Введение элементов с меньшей валентностью ( Ti, Zr) приводит к увеличению отношения Me: О, т.е. число дефектных мест в решетке и проводимость сплава при этом будут возрастать. [11]
Пятиокись ниобия и двуокись титана для опытов были получены из ло-паритового концентрата. [12]
Пятиокись ниобия часто бывает загрязнена пятиокисью тантала, а иногда и двуокисью титана. Для того, чтобы реакция прошла, необходимо увеличить количество окиси железа в исходной смеси окислов. При этом двуокись титана все же полностью не восстанавливается15, и значительная часть металла теряется со шлаком. [13]
Пятиокись ниобия в токе воздуха при 1350 С совершенно не испаряется. Опыты, проведенные методом потока, показали, что даже при большой удельной активности исходного препарата ( 15 мкюри / г) на коллекторе не обнаруживали следов радиоактивного налета. В вакууме пятиокись ниобия подвергается разложению. Рентгенографическое исследование продукта, оставшегося в эффузионной камере после прогрева пятиокиси ниобия в вакууме, показало значительное количество двуокиси ниобия в нем. [14]
Пятиокись ниобия с низким содержанием примесей широко применяется в различного рода исследованиях для получения радиоактивных изотопов ниобия, в качестве спектрографического стандарта, при синтезе различных ниобатов повышенной чистоты. Последние могут быть использованы для получения монокристаллов. [15]
Страницы: 1 2 3 4