Термохимический радиус
Cтраница 2
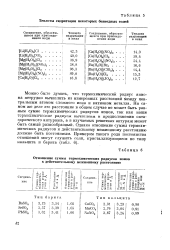 |
Теплоты гидратации некоторых безводных солей. [16] |
Можно было думать, что термохимический радиус аниона нетрудно вычислить из измеренных расстояний между центральным атомом сложного иона и катионом металла. На самом же деле это расстояние в общем случае не может быть равным сумме термохимических радиусов ионов, так как наши термохимические радиусы вычислены в предположении окта-эдрического антуража, а в изучаемых решетках антураж может быть самый разнообразный. Однако отношение суммы термохимических радиусов к действительному межионному расстоянию должно быть постоянным. [17]
При пользовании этим способом расчета термохимических радиусов требуется, чтобы соответствующие термохимические величины были определены с достаточной степенью точности ( ошибка в определениях не должна превышать 0 3 ккал), так как приходится иметь дело с разностью теплот образования и в неблагоприятном случае возможно суммирование экспериментальных ошибок. [18]
Полученные из экспериментальных данных величины термохимических радиусов ионов позволяют вычислить энергию кристаллической решетки солей, для которых она неизвестна из эксперимента. [19]
Несимметричные ионы характеризуются так называемым термохимическим радиусом, который, по Капустин-скому, изоэнергетически замещает данный ион в кристаллической решетке. Термохимические радиусы ионов могут быть рассчитаны, например, методом разностей, предложенным Янимирским. [20]
Как показали Капустинский и Яцимирский [62], термохимический радиус несферического иона не равен ни максимальному расстоянию от центра его до поверхности ( радиусу описанной сферы), ни минимальному расстоянию, а представляет собой некоторое среднее значение между этими двумя величинами. Так, например, термохимический радиус аниона 0 - равен 1 80 А; этот ион представляет собой эллипсоид вращения с полуосями, равными 1 98 и 1 24 А. [21]
Приведенные нами результаты расчетов показывают также, что термохимические радиусы ионов характеризуются таким же постоянством, как и радиусы, вычисленные из данных рентгеновского анализа. [22]
Известный интерес представляет приведенное в табл. 9 сопоставление термохимических радиусов треугольных и тетраэдрических ионов с положением их в периодической системе. [23]
 |
Схема эффекта внедрения. [24] |
Анализ приведенных данных показывает, что колебания в величине термохимических радиусов рассматриваемых ионов обычно не превышают колебаний в величине ионных радиусов, найденных по данным рентгеноструктур-ного анализа. Вместе с тем обращает внимание наличие определенной зависимости величины термохимического радиуса аниона от размера катиона: с увеличением размера противоположно заряженного иона термохимический радиус данного несферического иона увеличивается. Изменение величины термохимического радиуса иона едва достигает 2 %, но наличие его несомненно. [25]
Наличие подобной простой зависимости между радиусом описанной сферы и термохимическим радиусом иона позволяет вычислить термохимические радиусы для серии других ионов с аналогичным строением ( В0 -, BeFf -, JC4, SeOf -, TeOf -, P04 -, AsC4 -, Sb04 -, BiC4 -), поскольку для них известны радиусы описанных сфер и форма. [26]
Величина энергии решетки вычислялась по уравнению Ка-пустинского в предположении, что термохимический радиус иона [ Co ( NH3) 5HG02 ] 2 равен 2 36 А. Это значение было оценено исходя из того, что разность между теплотами образования упомянутых двух солей равна разности между теплотами образования соответствующих пурпуреохлоридов. [27]
В случае ионов, отличающихся по форме от шарообразных, мы, пользуясь термохимическими радиусами, впервые получаем возможность найти для них энергетические характеристики. [28]
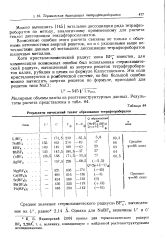 |
Результаты вычислений теплот образования тетрафтороборатов. [29] |
Хотя кристаллохимический радиус иона BF - известен, для компенсации возможных ошибок был использован термохимический радиус, вычисленный из энергии решеток тетрафтороборатов калия, рубидия и цезия по формуле Капустинского. [30]
Страницы: 1 2 3 4