Орбитальный радиус
Cтраница 1
Орбитальные радиусы представляют собой рассчитанные Уобером и Кро-мером кваитовомеханическим методом расстояния, соответствующие главному максимуму функции радиального распределения электронно. [1]
Орбитальный радиус центра бурения в платформе во время вертикальных перемещений и качки должен быть не более 5 % от глубины моря в точке бурения. [2]
Когда орбитальный радиус уменьшен, например в III группе у галлия, суммарный потенциал увеличен; у индия радиус увеличен, а потенциал уменьшен, такое же положение и в случае таллия; аналогично ведут себя и элементы IV группы... В этом обратном соотношении величин г и Е нет ничего удивительного, так как большей энергии связи электрона с атомом естественно отвечает большее его смещение в сторону ядра. Итак, можно констатировать, что 1) в IV периоде Zn, Ga, Ge, As отвечают малым радиусам и большим потенциалам; 2) в V периоде Cd, In, Sn - большим радиусам и малым потенциалам; 3) в VI периоде Hg, Tl, Pb - малым радиусам и большим потенциалам. [3]
Уменьшение орбитального радиуса 5 / - элементов обусловлено, как и в предыдущих случаях, лантаноидной контракцией. [4]
Уменьшение орбитального радиуса 5 -элементов обусловлено, как и в предыдущих случаях, лантаноидной контракцией. [5]
Так, орбитальный радиус атома калия составляет 216 пм, а радиус иона К - 59 пм; радиусы атома хлора и иона. [6]
Если использование орбитальных радиусов для интерпретации физико-химических характеристик веществ вполне правомочно, так как оно означает просто элементарное квантово-химическое рассмотрение, то противопоставление его кристаллохимическим ионным радиусам неоправдано. В самом деле, с точки зрения кристаллохимии орбитальные радиусы практически тождественны ковалентным и означают, следовательно, предположение о гомеополярном характере химических связей в неорганических кристаллах. Вместе с тем, огромный экспериментальный материал по свойствам неорганических веществ свидетельствует о преимущественно полярном характере их химических связей. [7]
В этом случае орбитальный радиус Зй-орбиталей сначала оказывается больше радиуса Зр-орбита-лей, особенно у первого элемента этой серии - Sc. Затем разность менаду ними постепенно уменьшается вплоть до Сг, а у Мп, имеющего устойчивую, согласно правилам Хунда, 3d5 - KOH m - гурацию, радиус Зй-орбиталей несколько меньше, чем Зр-орбиталей; далее от Мп до Zn эти различия увеличиваются. [8]
Достаточно сопоставить ход орбитальных радиусов 3d - и 4 -электронов, чтобы сделать новое качественное заключение. Поэтому эндо-эффект замены Ss-электрона на 4d будет облегчен, а энергетический перепад от Tcd4sa к Tcd5s сократится. [9]
В отличие от эффективного орбитальный радиус является характеристикой свободного атома или иона и не зависит от природы химической связи и других факторов. Для предсказания межатомных расстояний в молекулах и кристаллах необходимо знание орбитальных радиусов атомов не только в нормальном, но и в возбужденных состояниях. Однако даже с помощью мощных компьютеров задача вычисления орбитальных радиусов для возбужденных состояний атомов еще не решена. [10]
В отличие от эффективного орбитальный радиус является характеристикой свободного атома или иона и не зависит от природы химической связи и других факторов. Для предсказания межатомных расстояний в молекулах и кристаллах необходимо знание орбитальных радиусов атомов не только в нормальном, но и в возбужденных состояниях. Однако даже с помощью мощных компьютеров задача вычисления орбитальных радиусов для возбужденных состояний атомов еще не решена. [11]
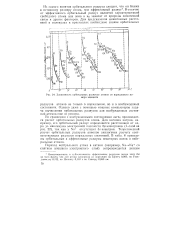 |
Зависимость орбитальных радиусов атомов от порядкового номера элемента. [12] |
В отличие от эффективного орбитальный радиус является характеристикой свободного атома или иона и не зависит от природы химической связи и других факторов. [13]
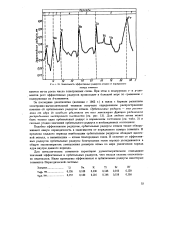 |
Зависимость эффективных радиусов атомов от порядкового. [14] |
Подобно эффективным радиусам, орбитальные радиусы атомов также обнаруживают явную периодичность в зависимости от порядкового номера элемента. В пределах каждого периода наибольшим орбитальным радиусом обладает щелочной металл, а наименьшим - атомы благородных газов. В отличие от эффективных радиусов орбитальные радиусы благородных газов хорошо укладываются в общую закономерность уменьшения размеров атома по мере увеличения заряда ядра внутри данного периода. [15]
Страницы: 1 2 3 4