Размещение - электрон
Cтраница 2
Правильное изображение размещения электронов в атомных орбиталях в пределах одного подслоя является важной задачей, решение которой позволяет оценивать способность атома образовывать химические связи с другими атомами и в конечном итоге предугадывать химические свойства элемента и главные свойства веществ, образованных с его участием. [16]
Такой порядок размещения электронов в атоме углерода представляет собой новый пример из общей закономерности, выражаемой правилом Хунда. [17]
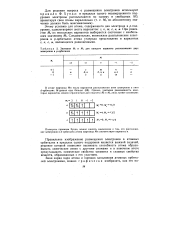 |
Значения М. и Ms для каждого варианта расположения двух электронов в р-орбиталях. [18] |
Правильное изображение размещения электронов в атомных орбиталях в пределах одного подуровня является важной задачей, решение которой позволяет оценивать способность атома образовывать химические связи с другими атомами и в конечном итоге предугадывать химические свойства элемента и главные свойства веществ, образованных с его участием. [19]
Такой порядок размещения электронов в атоме углерода представляет собой частный случай общей закономерности, выражаемой правилом Хунда: устойчивому состоянию атома соответствует такое распределение электронов в пределах энергетического подуровня, при котором абсолютное значение суммарного спина атома максимально. [20]
 |
Форма j - элек-тронного облака.| Схема, показывающая расположение леитронов атомах водорода и гелия по энергетическим уровням и орбиталям. [21] |
Определение закономерностей размещения электронов по энергетическим уровням дало возможность выяснить сущность явления периодичности: с возрастанием заряда ядра атомов периодически повторяются сходные свойства элементов, атомы которых имеют одинаковое число валентных электронов. [22]
Ввиду невыгодности размещения электронов на высоких энергетических уровнях орбиталям eg чаще всего соответствуют разрыхляющие молекулярные орбитали, орбиталям t g - связывающие молекулярные орбитали. Различают слабое и сильное поля лигандов, определяющие различное размещение d - электронов по орбиталям. [23]
Из последовательности размещения электронов в атомах следует, что самым длинным периодом является шестой, он содержит 32 элемента. Очевидно, логично строить периодическую систему, отражающую строение электронных оболочек атомов, на основе 32 клеток. [24]
Это правило размещения электронов в атомах по уровням энергии приводит к вполне определенным закономерностям в спектрах, что делает возможным его экспериментальную проверку. Так, например, в спектре неона уже нельзя наблюдать переходы между уровнями, отвечающими изменениям главного квантового числа от единицы до двух, поскольку соответствующие нижние состояния заняты электронами. [25]
Эти схемы размещения электронов и являются конфигурациями Н2 в методе МО. Участие в суперпозиции определяется требованием минимальной энергии. В терминах метода ВС взаимодействие конфигураций сводится к взаимодействию ковалентных структур, вроде Н - Н, и полярных, вроде Н Н -, с целью получить наиболее устойчивое состояние. Это очень сложно - в случае больших молекул, но еще осуществимо для циклобутадиена. Неэмпирический метод, известный как МОВК ( молекулярные орбиты с взаимодействием конфигураций), приводит к результатам, промежуточным по сравнению с результатами, полученными при помощи простых методов, но со значительно сокращенной шкалой энергии по сравнению с методом ВС. [26]
Такой порядок размещения электронов в атоме углерода представляет собой частный случай общей закономерности, выражаемой прав и л ом Хунда: устойчивому состоянию атома соответствует такое распределение электронов в пределах энергетического подуровня, при котором абсолютное значение суммарного спина атома максимально. [27]
Такой порядок размещения электронов в атоме углерода представляет собой частный случай общей закономерности, выражаемой правилом Хунда: устойчивому состоянию атома соответствует такое распределение электронов в пределах энергетического подуровня, при котором абсолютное значение суммарного спина атома максимально. [28]
Такой порядок размещения электронов в атоме углерода представляет собой частный случай общей закономерности, выражаемой правилом Хунда: устойчивому состоянию атома соответствует такое распределение электронов в пределах энергетического подуровня, при котором абсолютное значение суммарного спина атома - максимально. [29]
Такой порядок размещения электронов в атоме углерода представляет собой частный случай общей закономерности, выражаемой правилом Хунда: устойчивому состоянию атома соответствует такое распределение электронов в пределах энергетического подуровня, при котором абсолютное значение суммарного спина атома максимально. [30]
Страницы: 1 2 3 4