Размещение - электрон
Cтраница 3
Рассмотрим способ размещения электронов атомов по различным орбиталям. При этом основной принцип состоит в том, что электроны стремятся занять самые низкие по энергии орбитали. [31]
При - размещении электронов по разрешенным орбита-лям необходимо руководствоваться принципом Паули, согласно которому два электрона не могут иметь одинаковых наборов квантовых чисел. Если они имеют одинаковые орбитальные функции и различаются лишь значением спина, то также электроны называются спаренными. [32]
Правильность в размещении электронов нарушается тем, что в атомах с большим числом электронов иногда более отдаленные уровни обладают меньшей энергией, чем некоторые более близкие к ядру уровни предыдущей группы. Тогда внутренние уровни остаются незамещенными и заполняются позже в более отдаленных элементах периодической системы. В ряде редких земель, например, электроны постепенно заполняют оставшиеся свободными уровни подгруппы f IV группы, в то время как число электронов в наружном шестом слое остается одинаковым, равным двум. Так объясняется нарушение периодичности в семействе редких земель. Так же слабо сказывается влияние d - электронов внутри оболочки элементов вблизи железа, паладия, платины и урана. [33]
Вопрос о размещении электрона в анионе соединения ( I), а также в его натриевом аналоге, решается химическими превращениями двумиталлических производных нафтацена. [34]
Теперь нужно рассмотреть размещение электронов по этим орбиталям. В изолированных компонентах орбитали i R и ф8 могут быть пусты или могут содержать один или два электрона. Поэтому в объединенной системе на эти орбитали перейдут О, 1, 2, 3 или 4 электрона. [35]
Теперь нужно рассмотреть размещение электронов по этим орбиталям. В изолированных компонентах орбитали - фк и - ф5 могут быть пусты или могут содержать один или два электрона. Поэтому в объединенной системе на эти орбитали перейдут О, 1, 2, 3 или 4 электрона. [36]
На основе закономерностей размещения электронов по орбиталям объясните, почему лантаноиды и актиноиды обладают сходными химическими свойствами. [37]
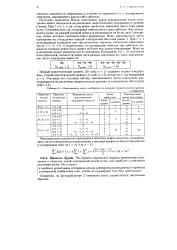 |
Максимальное число электронов на атомных энергетических уровнях. [38] |
Это правило определяет порядок размещения электронов в пределах одной электронной подоболочки для наиболее устойчивого состояния атома. [39]
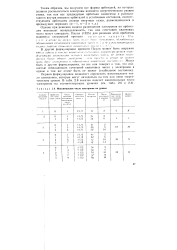 |
Максимальное число электронов на уровне. [40] |
Однако при решении задачи размещения электронов по орбиталям возникает неопределенность, так как сочетания квантовых чисел могут совпадать. [41]
Как вытекает из последовательности размещения электронов в атомах, самым длинным периодом является шестой, он содержит 32 элемента. Очевидно, логично строить периодическую систему, отражающую строение электронных оболочек атомов, на основе 32 клеток. [42]
Однако при решении задачи размещения электронов по орбиталям возникает неопределенность, так как сочетания квантовых чисел могут совпадать. [43]
Наличие незаполненных подгрупп при размещении электронов в более высоких подгруппах предопределяет многие особые свойства элементов: способность образовывать карбиды ( химические соединения с углеродом); нитриды ( химические соединения с азотом), устойчивость карбидов, нитридов; графитизирующую способность элементов. [44]
На рис. 123 приведена последовательность размещения электронов подуровней s, р и d первых квантовых слоев. Его спаренные электроны s - подуровня второго квантового слоя при возбуждении легко разъединяются. В этом же слое имеются незаполненные ячейки близкого р-подуровня. Таким образом, у атома бериллия можно получить два неспаренных электрона, чем объясняется химическая активность этого элемента. То же самое относится и к атому углерода. В нормальном состоянии углерод двухвалентен, но при некотором возбуждении два электрона s - подуровня второго квантового слоя при наличии в том же слое свободной р-ячейки разъединяются, и атом углерода становится четырехвалентным. [45]
Страницы: 1 2 3 4