Разность - электрохимический потенциал
Cтраница 3
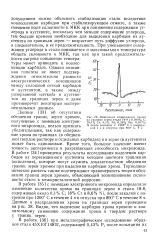 |
Изменение содержания хрома на границе зерен стали 18 - 8 с 0 099 % С. 18 1 % Сг. 8 6 % N1. 0 26 % Мо. 0 047 % N после закалки с 1200 С с выдержкой 4 ч и отпуска при 800 С, 8 ч. [31] |
Допущением можно объяснить стабилизацию стали вследствие коалесценции карбидов при стабилизирующем отжиге, а также смещение поля склонности к МКК при понижении содержания углерода в аустените, поскольку чем меньше содержание углерода, тем больше времени необходимо для выделения карбидов из ау-стенита по границам зерен - возрастает путь диффузии углерода, а следовательно, и ее продолжительность. При уменьшении содержания углерода в стали понижается и максимальная температура области склонности к МКК, так как при такой продолжительности нагрева повышение температуры может приводить к коалесценции карбидов. Однако описанная гипотеза не имеет подтверждения относительно разности электрохимических потенциалов между сплошной сеткой карбидов и аустенитом, а также между разорванной сеткой и аустенитом на границах зерен и даже противоречит некоторым экспериментальным данным. [32]
Уровни потенциальной энергии электронов, соответствующие ионам растворенных веществ. Очевидно, что каждому виду находящихся в растворе ионов соответствует определенный уровень полной потенциальной энергии электронов. Из сказанного ранее следует, что этот уровень может быть определен как разность электрохимического потенциала электронов и соответствующего концентрационного члена. [33]
Имеется в виду коррозионная стойкость металлического покрытия, а не пластической массы. В отношении коррозионно-устойчивости и, следовательно, срока службы металлические покрытия на пластических массах значительно превосходят такие же покрытия на металлах. Это объясняется тем, что исключается возможность образования локальных гальванических пар между пластмассовой основой и металлом покрытия. Как известно, появление гальванического тока ( разности электрохимических потенциалов) вызывает так называемую электрохимическую коррозию металлов. Примером может служить коррозия никелевых или хромовых покрытий по стали. [34]
Акцептор присоединяет два протона из внутренней фазы митохондриаль-ного матрикса. Создается градиент концентрации протонов - их избыток во внешней и недостаток во внутренней жидкой фазе. Вследствие этого происходит перенос протонов через мембрану в противоположном направлении, в результате чего и реализуется фосфорилирование - синтез одной молекулы АТФ приводит к поглощению двух протонов из внешней фазы и выделению двух протонов в матрикс. Митохондриальная мембрана работает как топливный элемент, в котором разность электрохимических потенциалов создается за счет окислительно-восстановительного процесса. [35]
А именно, чтобы присоединить к металлу и электролиту вольтметр, мы должны ввести в электролит второй электрод, а этот последний приобретет в свою очередь некоторый электрохимический потенциал относительно электролита и мы измерим лишь разность электрохимических потенциалов V-V, где V - электрохимический потенциал второго электрода. Однако для целей практики как раз и нужно знать только разность этих потенциалов. Действительно, всякий гальванический элемент всегда имеет два электрода и его электродвижущая сила ( напряжение при разомкнутой цепи) и есть разность электрохимических потенциалов Vt - V2 его электродов. Поэтому при измерении электрохимических потенциалов условились применять в качестве второго электрода определенные стандартные, легко воспроизводимые электроды, отличающиеся постоянством своих свойств. [36]
А именно, чтобы присоединить к металлу и электролиту вольтметр, мы должны ввести в электролит второй электрод, а этот последний приобретет в свою очередь некоторый электрохимический потенциал относительно электролита и мы измерим лишь разность электрохимических потенциалов V - V, где V - электрохимический потенциал второго электрода. Однако для целей практики как раз и нужно знать только разность этих потенциалов. Действительно, всякий гальванический элемент всегда имеет два электрода и его электродвижущая сила ( напряжение при разомкнутой цепи) и есть разность электрохимических потенциалов Vl - К2 его электродов. Но эта разность не зависит от того, относительно какого тела измерены электрохимические потенциалы V1 и V2 - Поэтому при измерении электрохимических потенциалов условились применять в качестве второго электрода определенные стандартные, легко воспроизводимые электроды, отличающиеся постоянством своих свойств. Для этого чаще всего употребляют нормальный водородный электрод, состоящий из платины, насыщенной водородом и находящейся в растворе, содержащем ионы водорода ( например, в растворе серной кислоты) с нормальной концентрацией. Для подобных измерений разработана специальная методика, которая, однако, уже относится к области физической химии, и поэтому подробнее мы не будем на ней останавливаться. [37]
В водных растворах электролитов существует несколько уровней полной потенциальной энергии электронов. В дальнейшем нас будут интересовать те уровни, которые связаны с присутствием в растворе положительных или отрицательных ионов. Рассмотрим вначале этот вопрос на примере чистой воды. Так как при равновесии электрохимический потенциал л э для любых уровней полной потенциальной энергии имеет одинаковое значение, определяемое формулой ( 152), полная потенциальная энергия электронов на данном уровне может быть выражена как разность электрохимического потенциала и концентрационного члена для этого уровня. [38]
 |
Схема, иллюстрлрующая связь между величинами дД (, дф в др.. [39] |
Как показал Гуггенгейм и как вытекает, в сущности, из цитированной работы Бренстеда, в рамках термодинамики соотношение (1.4) следует рассматривать как чисто формальное, поскольку на основе каких-либо термодинамических измерений невозможно приписать величинам ч и р определенные значения. Рассмотрим, например, некоторую проводящую конденсированную фазу А ( рис. 1.1 а), состоящую из внутренней однородной части /, поверхностного двойного слоя 2 и избыточного заряда 3, который на рисунке показан положительным. Работа обратимого изобарно-изотермического переноса заряженного компонента I из точки Ь, расположенной в однородной газовой фазе на бесконечном удалении от фазы Л, в точку а, находящуюся внутри фазы А, равна ( в расчете на 1 моль) разности электрохимических потенциалов р, компонента I в точках а и Ь и не зависит от выбора стандартного состояния. Определим для компонента i стандартное состояние так, чтобы значение ц в точке Ь равнялось нулю; тогда работа указанного переноса будет равна электрохимическому потенциалу лр компонента i в фазе А. [40]
Kara вой, который показал, что каталитический центр фермента локализован в fi - субъединице, а в а - находится центр связывания ADP. Комплекс упЕ взаимодейстаует с F, блокируя его протонную проводимость. Канальная часть непосредственно взаимодействует с воротами, переход которых из закрытого в открытое состояние управляется либо разностью электрохимического потенциала протоноа на мембране, либо гидролизом АТР в транс - формере. [41]
 |
Схема хемиосмоти. [42] |
Схема хемиосмотического сопряжения Митчелла показана на рис. 13.7. Сопрягающей системой является мембрана. Донор водорода АН2 ( например, аскорбат) окисляется переносчиком электронов ( например, цитохромом с) у внешней стороны мембраны. Акцептор присоединяет два протона из внутренней фазы митохондртиального матрикса. Создается градиент концентраций протонов - их избыток во внешней и недостаток во внутренней жидкой фазе. Вследствие этого происходит перенос протонов через мембрану в противоположном направлении, в результате чего и реализуется фосфоршгарование. Синтез одной молекулы АТФ приводит к поглощению днух протонов из внешней фазы и выделению двух протонов в матрикс. Митохон-дриальная мембрана работает как топливный элемент, в котором разность электрохимических потенциалов создается за счет окислительно-восстановительного процесса. [43]
Мембрана нервной клетки содержит много тысяч натриевых каналов с потенциал-зависимыми воротами, и общий натриевый ток складывается из токов, протекающих через все эти каналы. Как же в таком случае ведут себя отдельные каналы. Поскольку все они, видимо, идентичны по структуре, можно было бы думать, что ток, проходящий через каждый канал, возрастает и падает одновременно с увеличением и уменьшением общего тока, т.е. разные каналы одного и того же типа действуют строго синхронно. Вместо этого отдельные каналы после деполяризации могли бы внезапно открываться и закрываться по принципу все или ничего, но действовать асинхронно, несогласованно. В этом случае при более детальном исследовании должны обнаружиться непредсказуемые колебания тока: на идеализированную кривую тока будут накладываться небольшие, но резкие беспорядочные флуктуации, отражающие открывание и закрывание отдельных каналов. И действительно, такие флуктуации можно наблюдать. Очевидно, индивидуальные каналы открываются не плавно и ие вполне одновременно. На основе предположения, что у каждого канала имеются только два возможных состояния проводимости-он либо полностью закрыт, либо полностью открыт-и переход из одного состояния в другое происходит мгновенно, с помощью флуктуационного анализа для проводимости одного открытого натриевого канала ( в нерве лягушки) была получена величина около 10 - 11 См. Это означает, что при разности электрохимических потенциалов в 100 мВ через открытый канал протекает ток силой 10 - 12 А, что соответствует прохождению примерно 6000 ионов Na в I мс. [44]
Страницы: 1 2 3