Разность - электроотрицательность - атом
Cтраница 2
 |
Дипольные моменты отдельных связей в молекулах типа АВг различного строение. [16] |
Поэтому в ряду сходно построенных молекул дипольныи момент возрастает по мере увеличения разности электроотрицательностей атомов, образующих молекулу. [17]
 |
Днпольные моменты отдельных связей в молекулах типа АВ2 различного строения. [18] |
Поэтому в ряду сходно построенных молекул дипольный момент возрастает по мере увеличения разности электроотрицательностей атомов, образующих молекулу. [19]
Поэтому в ряду сходно построенных молекул дипольныи момент возрастает по мере увеличения разности электроотрицательностей атомов, образующих молекулу. [20]
Поэтому в ряду сходно построенных молекул дипольный момент возрастает по мере увеличения разности электроотрицательностей атомов, образующих молекулу. [21]
Проанализировать, как зависит энергия химической связи от ее длины; кратности; степени перекрывания электронных облаков; разности электроотрицательности атомов; степени ионности связи; количества электронов на связывающих и разрыхляющих молекулярных орбиталях. [22]
В гетероядерной двухатомной молекуле АВ, где В - более электроотрицательный атом, чем А, связывающая молекулярная орбиталь содержит больший вклад атомной орбитали атома В, а разрыхляющая молекулярная орбиталь больше напоминает атомную орбиталь атома А. Если разность электроотрицательностей атомов А и В очень велика, как, например, в KF, валентные электроны локализуются на более электроотрицательном атоме ( в данном случае F) и представление о ковалентной связывающей орбитали теряет свой смысл. [23]
В оригинальной трактовке Полинга различия в электроотри-цательностях рассматриваются в качестве единственной причины отклонения энергии химической связи в двухатомной молекуле типа А-В от среднеарифметического значения для симметричных молекул типа А-А и В-В. Принимается, что квадратный корень этого отклонения пропорционален разности электроотрицательностей атомов А и В. [24]
Различный химический характер водорода в СН4, Н2О и HF объясняется различной полярностью и поляризуемостью его связей в этих соединениях. Полярность связей, как известно, количественно характеризуется разностью электроотрицательностей атомов, образующих эти связи. [25]
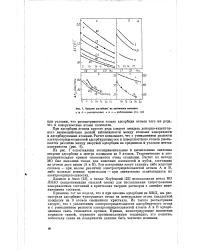 |
Энергии адсорбции на различных металлах. [26] |
Применив тот же подход, что и при анализе адсорбции на ММД, мы рассмотрели адсорбцию чужеродного атома на центральном атоме квадратной площадки из 9 атомов смешанного кристалла. Из такого рассмотрения следует, что с увеличением электроотрицательности адсорбируемого атома и с уменьшением разности электроотрицательностей атомов А и В адсорбционная связь становится прочнее. Кривые, иллюстрирующие изменение порядков связей, отражают противоположную тенденцию; это понятно, поскольку связи на поверхности должны быть частично ионными. [27]
В дальнейшем будет показано, что энергии ионного резонанса возрастают с увеличением разности электроотрицательности двух атомов: Н и X. Если вычислить Ет для различных связей, то получается ряд величин, являющихся некоторой функцией разности электроотрицательности атомов, образующих связь. [28]
Перекрытие р-орбиталей обусловливает основную ковалентную компоненту энергии решетки, присутствующую даже в ионных соединениях галогенидов щелочных металлов. В соответствии с концепцией электроотрицательности сдвиг и понижение зарядов на ионах тем сильнее, чем больше разность электроотрицательностей атомов неметалла и металла, Энергия решетки карбидов, нитридов и окислов складывается из ковалентной составляющей, обусловленной валентными а-связями перекрывающихся р-орбиталей и ионной, кулоновской связи возникающей вследствие притяжения ионов Ме и X, несущих небольшой эффективный заряд z, и действующей также вдоль валентных связей. [29]
В качестве параметра, определяющего возможность образования твердого раствора замещения, используют различие в степени ионности связи, иногда - разность электроотрицательностей атомов замещающих друг друга элементов и др. Непрерывные твердые растворы замещения образуются между изоморфными металлами, близко стоящими в таблице Менделеева. В качестве примеров можно привести системы: Ag-Au, K-Rb, Se-Te, Mo-W, Au-Cu, Ge-Si, Nb-Ta, Co-Ir, состоящие из близких компонентов одной группы; Ir-Pt, Au-Pt, Cu-Ni, Ni-Fe, Fe-Cr, состоящих из близких компонентов одного периода; Au-Pd, Co-Pd, Fe-Pd, состоящие из компонентов близких групп и периодов. [30]
Страницы: 1 2 3