Разность - энтропия
Cтраница 2
Разность энтропии, используемую в последнем доказательстве, можно рассматривать как меру уменьшения неопределенности У вследствие того, что известно X. Другими словами, это есть мера количества информации об У, содержащейся в X. Отметим замечательный факт, заключающийся в том, что эта разность симметрична относительно X и У. [16]
Разностью энтропии атомных колебаний CH3OD и СН3ОН, в которых не участвует атом водорода, замещаемый дейтерием, здесь пренебрегаем. [17]
Определить разность энтропии 1 г воды при 0 и 100 С ( давление нормальное), считая теплоемкость воды постоянной и равной 4 19 дж / г-град. [18]
Поскольку разность энтропии нормальной и сверхпроводящей фаз ( 5Н - 5) с обращается в нуль при Т Гк и при Т О К, то очевидно, что зависимость ( 5Н - 5С) I ( Т) проходит через максимум. [19]
Вместо разности энтропии можно ввести более наглядную и легко определяемую экспериментально теплоту превращения жидкости в газ. Двухфазную систему можно подогревать, не меняя в ней ни давления, ни температуры. [20]
Теоретически разность энтропии поступательного движения для Lit ( г.) и LI ( водн. В небольшой степени величину - 212 Дж-град 1-моль - 1 для суммы, относящейся к этим ионам, можно отнести за счет межионного взаимодействия в данном растворе ( разд. [21]
Величина разности энтропии А 5 может быть получена из значений энтропии реагентов и конечных продуктов реакций, которые вычисляются в каждом случае либо посредством а) применения третьего закона термодинамики к данным о теплотах превращения, теплотах плавления, теплотах испарения и к теплоемкостям, вплоть до низких температур, либо с помощью б) статистического вычисления, использующего спектроскопические и другие молекулярные данные. [22]
Величина разности энтропии пара и жидкости связана с величиной скрытой теплоты испарения. [23]
Пренебрегая разностью энтропии, Странский и Каишев сначала предположили, что разность энергий сцепления для молекул, находящихся в различных положениях, равна разности химических потенциалов. [24]
Чему равна разность энтропии ( в Дж-град - 1-моль - 1) гелия при давлении 1 и 5 атм и 25 С. [25]
Выражение для разности энтропии двух состояний приобретает особенно простой вид при обратимом изотермическом процессе. [26]
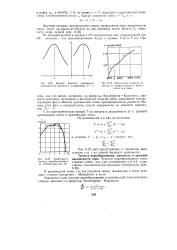 |
Кривая фазового равновесия ( пограничная кривая в координатах Т - s.| Зависимость энтропии от. [27] |
Клапейрона-Клаузиуса, разность энтропии, энтальпии и внутренней энергии обеих равновесно сосуществующих фаз в области критической точки пропорциональна разности объемов этих фаз, а следовательно, корню квадратному из разности температур ТК-Т. [28]
 |
Однозначность энтропии. [29] |
Выражение для разности энтропии двух состояний принимает простой вид при обратимом изотермическом процессе. [30]
Страницы: 1 2 3 4