Разрыв - водородная связь
Cтраница 4
Хорошим критерием деструкции нативной структуры ( разрыва водородных связей) служит молярный коэффициент экстинк-ции е ( Р) в ультрафиолетовой области спектра, где дезоксирибонуклеиновая кислота имеет широкий максимум поглощения в области 2580 - 2630 А. [46]
Вызываемая водой пластификация полимеров в результате разрыва гидрофобных водородных связей между полимерными цепями представляет собой довольно общее явление. Показано ( 30), что снижение температуры стеклования композиции эпоксидная смола - диамин пропорционально количеству воды в системе. Джонсон и др. ( 27) сообщают о том, что полисульфон и поливинилацетат в ходе диэлектрических измерений обнаруживают в области низких температур более заметный р-пере-ход, чем в случае некластеризованной воды. Кластеризованная вода в поливинилацетате не оказывает никакого влияния на температуру стеклования ГСт, хотя и наблюдается сдвиг Гст при увеличении количества некластеризованной воды. [47]
 |
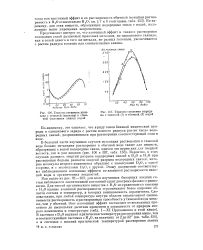
Схема структуры льда.| Диаграмма состояния воды в области невысоких давлений. [48] |
При нагревании воды часть теплоты затрачивается на разрыв водородных связей ( энергия разрыва водородной связи в воде составляет примерно 25 кДж / моль), Этим объясняется высокая теплоемкость воды. [49]
Хотя в этой статье авторы используют термин разрыв водородной связи, следует напомнить, что Попл [5] предположил не разрыв, а деформацию водородных связей. Если увеличение потенциальной энергии при изгибе водородной связи относительно невелико, как это предполагается [6], то такое описание должно быть предпочтительным. [50]
 |
Диаграмма состояния воды в области невысоких давлений. [51] |
При нагревании воды часть теплоты затрачивается на разрыв водородных связей. Этим объясняется высокая теплоемкость воды. [52]
В работе [2] приближенно рассчитано изменение энергии разрыва водородной связи при замещении образующего ее атома водорода дейтерием. Это было сделано для метилового дейтероспирта и тяжелой воды по спектральным данным относительно колебаний, в которых участвует замещаемый атом водорода. [53]
Как видке, двойная спираль ДНК вследствие разрыва водородных связей, удерживающих вместе пары оснований, разделяются на две полинуклеотидные цепи. [54]
Однако около 25 С эффект увеличения энергии разрыва водородных связей в воде при замещении водорода дейтерием примерно в семь раз больше эффекта уменьшения энергии ван-дер-ваальсового взаимодействия молекул ( см. гл. Поэтому вызывает удивление то, что изотопные эффекты в поверхностной энергии тяжелой воды, обусловленные двумя указанными факторами, при 25 С почти компенсируют друг друга, а уже при 100 С ослабление ван-дер-ваальсового взаимодействия молекул D20 по сравнению с Н20 влияет на поверхностную энергию тяжелой воды сильнее, чем увеличение энергии разрыва связи OD-О относительно связи ОН-О. [55]
 |
Теплоты смешения диок.| Теплоты смешения пиридина с тяжелой ( / и обычной ( 2 водой. [56] |
Вероятно, в этих случаях разность энергий разрыва водородных связей в D20 и Н20 при растворении больше разности энергий разрыва водородных связей, которые молекулы второго компонента образуют с молекулами D20, с одной стороны, и с молекулами Н20, с другой. Этому допущению соответствуют наблюдавшиеся изотопные эффекты во взаимной растворимости тяжелой воды и органических жидкостей. [57]
 |
Димер муравьиной кислоты. [58] |
Чтобы найти увеличение внутренней энергии, отвечающее разрыву одиночной водородной связи в газовой фазе, нужно из величины АЯр вычесть RT и разность поделить пополам. В соответствии с этим Д51 разрыва одиночной водородной связи в газовой фазе при 400 К оказывается равной 6 76 0 15 ккал. Обозначим связь СО в одной молекуле через Л, а связь О - Н в другой молекуле через В. [59]
Это смещение в сторону меньших частот при разрыве водородных связей имеет направление, противоположное тому, которое характерно для полос поглощения, обусловленных валентными колебаниями, а именно полос ОН и NH вблизи 3300 см 1; однако такого направления сдвига и следует ожидать в случае изменений деформационных частот. Как и в случае полосы амид-I, величина смещения при переходе от твердого состояния к разбавленному раствору зависит от сложности молекулы. Для сложных веществ, в которых геометрия молекулы такова, что водородные связи в кристаллической решетке не образуются, смещения, наблюдаемые при растворении, невелики. Частота полосы 1515 см 1 твердого бензилпенициллина, например при его растворении, заметно не изменяется. [60]
Страницы: 1 2 3 4 5