Разряд - ион - водород
Cтраница 1
Разряд ионов водорода не протекает, однако, с ощутимой скоростью при незначительном отклонении потенциала от равновесного значения. [1]
Разряд ионов водорода на зеркальной поверхности ртути требует значительно большего напряжения, чем разряд на платине. Так, на платиновых электродах водород выделяется ( из раствора кислоты) при напряжении 1 7 в, а на ртутном катоде это напряжение возрастает до 2 5 в и больше. Таким образом, перенапряжение водорода при выделении его на ртути очень велико. [2]
Разряд ионов водорода и молекул воды является реакцией, протекающей с измеримой скоростью также и в случае электродов с низким перенапряжением. В этом случае атом водорода, образующийся в результате электрохимической реакции, остается растворенным в металле без образования молекул водорода или выделения повой фазы, а при анодном процессе атом водорода подобным же образом черпается из раствора в металле. [3]
Разряд иона водорода оставляет гидроксильные ионы в избытке, и таким образом раствор вокруг катода становится щелочным. Поверхностные слои цинкового анода можно рассматривать как освобожденные от свободных валентных электронов, однако, электронейтральность поддерживается приходом соответствующего количества отрицательно заряженных ионов хлора. [4]
Разряд ионов водорода потекает в несколько стадий. К их числу прежде всего относится диффузия ионов гидроксония из глубины раствора к катоду. Далее следует собственно электрохимический акт разряда водородных ионов одновременно с их дегидратацией. Из этого следует, что водородное перенапряжение вообще определяется суммой трех слагаемых: перенапряжения диффузии, обусловленного задержкой переноса ионов водорода к катоду, перенапряжения перехода, связанного с торможением электрохимической стадии ассимиляции электрона водородным ионом, и, наконец, перенапряжения реакции, возникающего вследствие задержки рекомбинации. [5]
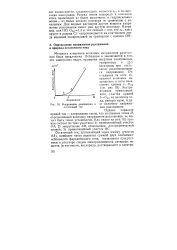 |
Напряжение разложения и остаточный ток. [6] |
Разряд ионов водорода в конечном итоге происходит из более щелочного, а гидроксильных ионов - из более кислого раствора по сравнению с начальным. Для водных растворов других веществ напряжение разложения имеет уже другую величину. [7]
Рассмотрим разряд ионов водорода в разбавленных растворах кислоты с добавкой 1 1-валентного электролита при отсутствии специфической адсорбции ионов раствора. Такие условия реализуются, например, в растворах НС1 КС1, так как области катодного выделения водорода на ртути соответствуют большие отрицательные заряды, при которых ионы С1 - не адсорбируются на ртутном электроде, а ионы К специфической адсорбируемостью практически не обладают. [8]
Рассмотрим разряд ионов водорода из раствора 1 1 -валентного электролита при отсутствии специфической адсорбции ионов раствора. Такому условию отвечает раствор НС1 КС1, поскольку при больших отрицательных зарядах поверхности, при которых исследуется выделение водорода на ртути, ионы С1 - специфически не адсорбируются; небольшой специфической адсорбцией ионов К на ртути можно практически пренебречь. [9]
Рассмотрим разряд ионов водорода из раствора 1 1-валентного электролита при отсутствии специфической адсорбции ионов раствора. Такому условию отвечает раствор НС1 КС1, поскольку при больших отрицательных зарядах поверхности, при которых исследуется выделение водорода на ртути, ионы С1 - специфически не адсорбируются; небольшой специфической адсорбцией ионов К на ртути можно практически пренебречь. [10]
Потенциал разряда ионов водорода на других электродах оказывается отличным от потенциала на платинированной платине. Для разряда водорода на других электродах требуются значительно большие отрицательные потенциалы, величина которых зависит от природы взятых электродов. [11]
Волна разряда ионов водорода симметрична, ее форма описывается уравнением для необратимых волн [ см. стр. [12]
Скорость разряда ионов водорода с образованием газообразного водорода при любом данном рН зависит от каталитических свойств поверхности катода. Это свойство в свою очередь определяется разностью потенциалов катода, на котором разряжаются ионы водорода, и равновесным потенциалом водородного электрода в том же самом растворе. Эту разность потенциалов в вольтах называют перенапряжением водорода. Чем выше перенапряжение водорода, тем медленнее происходит реакция ( 2) и тем медленнее происходит соответствующая анодная реакция ( 1), которая не может протекать быстрее, чем более медленная катодная реакция. [13]
Для разряда ионов водорода на ртути расчет по формуле (49.27) дает Q19 кДж / моль. Так, величине Q19 кДж / моль соответствует значение д ( Д р) равн / дГ 0 7 мВ / град. [14]
Для разряда ионов водорода на ртути расчет по формуле (49.29) дает Q 4 6 ккал / моль. [15]
Страницы: 1 2 3 4