Разряд - ион - водород
Cтраница 3
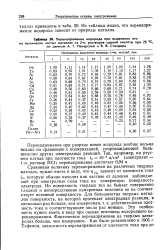 |
Перенапряжение водорода при выделении его. [31] |
Перенапряжение при разряде ионов водорода вообще весьма велико по сравнению с поляризацией, сопровождающей большинство других электродных реакций. [32]
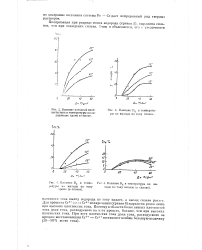 |
Влияние катодной плотности тока и температуры на содержание хрома в сплаве.| Влияние Dk и температуры на выходы по току сплава. [33] |
Поляризация при разряде ионов водорода ( кривая 5), выражена сильнее, чем при осаждении сплава. [34]
Перенапряжение при разряде ионов водорода в безводном ацетонитриле значительно ниже, чем в воде. Котце и Кольтгоф [38] исследовали большое количество кислот в ацетонитриле и нашли значительно больший разброс значений потенциалов полуволны для этих кислот, чем в водных растворах; однако на основании только значений потенциалов полуволн в ацетонитриле нельзя сравнивать между собой силу отдельных кислот [38], поскольку их восстановление протекает необратимо. [35]
На катоде протекает разряд ионов водорода и выделяется водород. [36]
На катоде происходит разряд ионов водорода и образование щелочи. [37]
На катоде протекает разряд ионов водорода и выделяется водород. [38]
В случае реакции разряда иона водорода последняя величина связана с потенциалом электрода экспоненциальной зависимостью. Поэтому In [ A0 представляет линейную функцию потенциала электрода ср. [39]
Относительно высокое перенапряжение разряда ионов водорода на меди означает практически полное прекращение коррозии меди с водородной деполяризацией в растворах НС1, СО2 и других кислотах. Однако при наличии в растворах этих кислот молекулярного кислорода медь легко подвергается коррозии с кислородной деполяризацией. Водород не может выделяться при коррозии этого металла, несмотря на низкое значение рН ореды. В этом отношении медь отличается от железа, которое в кислой среде может переходить в раствор, выделяя водород, так как нормальный потенциал и перенапряжение водорода на нем ниже, чем у меди. Потенциалы кислородного электрода при контакте этих двух металлов с одной и той же средой практически одинаковы. Кислородная коррозия при диффузионном контроле процесса будет развиваться практически по одной и той же схеме на обоих металлах. [40]
Рассмотрим кинетику процесса разряда ионов водорода. [41]
Построение полной теории разряда ионов водорода, как и других электродных процессов, требует углубленного рассмотрения механизма самого элементарного акта разряда. На значение энергии адсорбции атомов водорода для определения величины перенапряжения, хотя и с иной точки зрения, было впервые указано в работе Н. И. Кобозева и Н. И. Некрасова [40], в которой была также впервые учтена возможность одновременного течения реакции образования молекулы водорода на том же электроде по различным механизмам. К сожалению, наличие в этой работе других, неправильных, утверждений, о которых я скажу далее, привело к тому, что положительные ее стороны не были сразу полностью оценены. [42]
При рассмотрении скорости разряда ионов водорода в концентрированных р створах возникает трудность, близкая по характеру трудностям, о которых упоминалось выше. Скорость разряда иона должна зависеть от его активности. Между тем, кчк известно, в концентрированных растворах но могут быть определены активности отдельных ионов, а лишь их произведения, отвечающие элсктронойтрчлыюй комбинации ионов. Определение активностей отдельных ионов было бы возможно, если бы могли быть определены отдельные скачки потенциала электрод-раствор, таким образом, проблема активностей отдельных ионов связана с проблемой абсолютных потенциалов. [43]
Обе реакции сопровождаются разрядом ионов водорода. [44]
По этому механизму протекает разряд ионов водорода на металлах, которые плохо катализируют реакцию 2Надс - - - Н2 и на которых плотность тока обмена имеет небольшую величину. [45]
Страницы: 1 2 3 4