Разряд - ион - цинк
Cтраница 1
 |
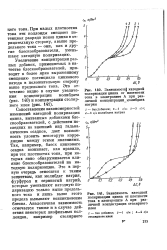
Тафелевские зависимости для смеси 1 М соляной кислоты с гало-генидами калия. 2М хлорид ( кривая /. 2М бромид ( 2 и 2М иодид ( 3. ( Тза Чюань-синь и Иофа. [1] |
Разряд ионов цинка на цинковой амальгаме был подробно изучен Корытой [52] методом классической полярографии. [2]
 |
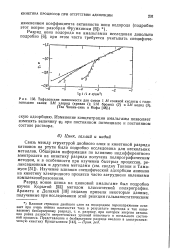
Кривая пассивирования цинкового электрода в 2N ZnSO4 ( pH 4 5 при 7к2 ма / см3 и t 8 ( Ваграмян, Соловьева. [3] |
Это означает, что разряд ионов цинка в данном случае сильно затруднен. [4]
Однако сопоставление равновесного потенциала разряда ионов цинка с равновесными потенциалами водородного электрода в кислой и щелочной средах ( см. рис. 16) может привести к выводу, что выделение цинка мало вероятно не только в кислой, но и в щелочной среде. Но практика подтверждает возможность осаждения цинка из очень кислых растворов. Возможность электролитического осаждения цинка в нейтральных и кислых растворах определяется значительным перенапряжением выделения водорода на цинке, составляющим около - 0 7 в. [5]
Как уже отмечалось, на разряд ионов цинка расходуется почти весь ток, так как выделение водорода ничтожно мало. [6]
Из приведенных данных видно, что разряд ионов цинка совершается со значительной скоростью при сравнительно незначительной поляризации. [7]
При катодном обезжиривании не исключена возможность разряда ионов цинка, олова и других металлов, накапливающихся в электролите, что может быть причиной дефектных покрытий, поэтому перед выгрузкой деталей из обезжиривающих ванн рекомендуется кратковременное обезжиривание деталей на аноде. [8]
Корыта нашел, что для реакции разряда иона цинка на амальгаме цинка в растворах 0 1 - 1 0 М нитрата калия величины кажущейся стандартной константы скорости k, определенные экспериментально и рассчитанные на основании теории Гун - Чапмана, находятся в достаточно хорошем согласии. Арамата и Делахей [18] нашли хорошее согласие с поправкой Фрумкина, исследуя разряд иона цинка из растворов, которые содержали перхлораты магния или бария ( см. табл. 11), однако в растворах перхлоратов натрия и аммония были обнаружены существенные отклонения от теории. Авторы приписывают эти отклонения различию в радиусах ионов цинка и катионов индифферентного электролита ( разд. [9]
При малых плотностях тока эти коллоиды смещают потенциал разряда ионов цинка в отрицательную сторону, а выше предельного тока - они, как и другие блескообразователи, уменьшают катодную поляризацию. [11]
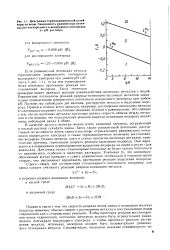 |
Диаграмма термодинамической устойчивости воды. Зависимость равновесных потенциалов кислородного и водородного электродов от рН раствора. [12] |
Однако в связи с тем, что скорости разряда ионов цинка и ионизации молекул водорода невелики, обычно говорят о растворении металла и восстановлении ионов гидроксония как о сопряженных реакциях. Чтобы протекала реакция восстановления ионов гидроксония, потенциал электрода должен быть отрицательнее равновесного потенциала водородного электрода, а чтобы протекала реакция растворения металла, потенциал электрода должен быть положительнее равновесного потенциала металла. [13]
В кислых электролитах ( сернокислых, борфтористоводород-ных и др.) происходит катодный разряд ионов цинка, образующихся при электролитической диссоциации простых солей цинка. [14]
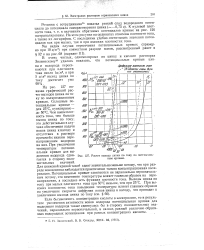 |
Расчет выхода цинка по току по потенцчаль-ным кривым. [15] |
Страницы: 1 2 3