Разряд - ион - цинк
Cтраница 2
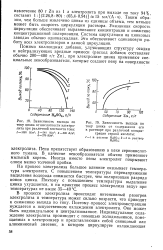
Для цинковой кривой такой сдвиг значительно меньше потому, что при разряде ионов цинка наблюдается практически только концентрационная поляризация. Потенциальные кривые сдвигаются не параллельно первоначальным потому, что изменение температуры влияет главным образом на перенапряжение, а последнее есть функция плотности тока. [16]
Следовательно, скорость саморастворения амальгамы ничтожно мала по сравнению со скоростями процессов ионизации и разряда ионов цинка, а стационарный потенциал амальгамы практически совпадает с ее равновесным потенциалом. [17]
Феттер [52] считает, что в настоящее время еще нельзя решить, как, например, при разряде иона цинка, переходят два электрона - одновременно или последовательно, по стадиям. Нам, исходя из общих соображений, кажется более вероятным второе. [18]
Увеличение содержания воды приводит к снижению энергии активации в катодном процессе, а также к последовательной смене механизма процесса разряда ионов цинка. [19]
Линейный характер зависимости Е - lg ( a в исследованном интервале потенциалов показывает, что одновременное протекание сопряженного процесса разряда ионов цинка не влияет на кинетику анодного процесса, скорость которого при данной концентрации амальгамы определяется ее потенциалом. То же наблюдается и для катодного процесса в области равновесного потенциала. [20]
Ройтер с сотрудниками ( 1939 г.) при помощи осциллографа установил, что разряд ионов железа при том же значении поляризации происходит в 1000 раз медленнее разряда ионов цинка. [21]
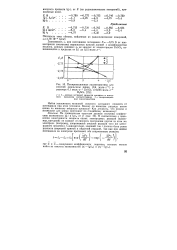 |
Поляризационные характеристики для. [22] |
Влияет ли кинетика разряда ионов цинка на кинетику анодного процесса. Как доказать, что разряд и ионизация для цинка протекают по стадийному механизму. [23]
Область потенциалов предельного тока свинца простирается только до потенциала, при котором становится возможным разряд ионов кадмия. Область потенциалов предельного тока кадмия простирается до потенциала разряда ионов цинка и так далее до потенциала разряда ионов калия, прибавленного в качестве постороннего электролита. Если концентрация ионов калия того же порядка, что и перечисленных выше катионов, то можно получить пять волн; шестое увеличение силы тока, соответствующее уже разряду ионов водорода воды, ни при каких условиях не будет иметь площадки предельного тока ( см. пунктирную кривую, рис. 32), так как стационарное состояние здесь не наступает. [24]
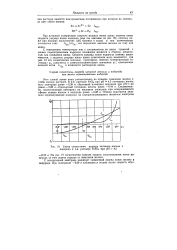 |
Схема совместного разряда катионов железа и 1водорода в 1-я. растворе РеЗСч при рН 4 5. [25] |
С повышением температуры или с соосаждением на цинке примесей с малым перенапряжением водорода положение меняется в сторону, невыгодную для осаждения цинка. Скорость разряда ионов водорода заметно увеличивается, а скорость разряда ионов цинка практически мало изменяется ( на ряс. [26]
Влияние анионов возрастает в ряду: РО34 -, COS, SO2 -, ОН -, F, СН8СО2 -, СГ, CN -, ВгОГ, МОГ, Вг -, С1ОГ I, SCN и С1ОГ - Этот ряд сильно отличается от последовательности тех же анионов, расположенных по их адсорбционной способности на ртути в отсутствие ионов тетраалкиламмония, а именно F, ОН, СОз -, SO - f, СЮГ. Аналогичные результаты были получены Гирстом с сотрудниками при изучении разряда иона цинка, иодат-иона, при исследовании системы Ей ( III) / Ей ( II) и некоторых других электродных процессов. Они пришли к выводу, что совместная адсорбция катиона тетраалкиламмония и неорганического аниона сама по себе не может еще объяснить полученных результатов, и важную роль играет ассоциация ионов. Далее первый ряд анионов напоминает последовательность, по которой происходит понижение поверхностного натяжения на границе раздела раствор / воздух и которая соответствует степени фиксации анионов анионообменными смолами с ионами тетраалкиламмония в качестве активных групп. [27]
На процесс электролиза большое влияние оказывает температура электролита. С повышением температуры перенапряжение выделения водорода снижается быстрее, чем поляризация разряда ионов цинка. Поэтому с повышением температуры выделение цинка ухудшается, и на практике процесс электролиза ведут при температурах не выше 35 - 40 С. [29]
Корыта нашел, что для реакции разряда иона цинка на амальгаме цинка в растворах 0 1 - 1 0 М нитрата калия величины кажущейся стандартной константы скорости k, определенные экспериментально и рассчитанные на основании теории Гун - Чапмана, находятся в достаточно хорошем согласии. Арамата и Делахей [18] нашли хорошее согласие с поправкой Фрумкина, исследуя разряд иона цинка из растворов, которые содержали перхлораты магния или бария ( см. табл. 11), однако в растворах перхлоратов натрия и аммония были обнаружены существенные отклонения от теории. Авторы приписывают эти отклонения различию в радиусах ионов цинка и катионов индифферентного электролита ( разд. [30]
Страницы: 1 2 3