Разряд - ион - гидроксоние
Cтраница 3
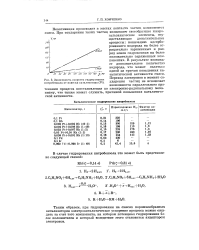 |
Зависимость скорости гидрирования нитробензола от навески катализатора ( Ft. [31] |
Коактивация происходит в местах контакта частиц компонентов смеси. При соударении таких частиц возникают своеобразные микрогальванические элементы, осуществляющие дополнительные процессы: ионизацию адсорбированного водорода на более отрицательно заряженных и разряд ионов гидроксония на более положительно заряженных компонентах. В результате возникает дополнительное количество водорода, что может являться одной из причин повышения каталитической активности смеси, Переход электронов в момент соударения частиц не исключает возможности параллельного протекания процесса восстановления по электронно-радикальному механизму, что также может служить, причиной повышения каталитической активности. [32]
Известно, что небольшое включение более благородных металлов в основной металл приводит к резкому увеличению скорости коррозии. Причина этого явления заключается в следующем. Поскольку скорость разряда ионов гидроксония на меди значительно больше скорости этой же реакции на цинке, нетрудно понять, почему повышается скорость коррозионного процесса при наличии в основном металле подобного включения. [33]
На катоде электролизера выделяется водород, на аноде - кислород. Механизмы выделения водорода из кислых и щелочных электролитов различны. В кислых электролитах происходит разряд иона гидроксония ( НзО), в щелочных - непосредственное присоединение электронов к молекуле воды. [34]
Так обстоит дело с влиянием состава раствора на скорость стадии разряда в предположении, что температура и природа металла, из которого изготовлен электрод, остаются неизменными. Однако нельзя забывать, что из теории замедленного разряда следует: с увеличением температуры скорость электродного процесса, как правило, повышается. Например, в результате разряда ионов гидроксония или молекул воды образуется промежуточный продукт - атомы водорода, которые очень хорошо адсорбируются на поверхности платинового электрода и значительно хуже на поверхности ртути. Именно поэтому при замене ртутного катода платиновым скорость выделения водорода при электрохимическом разложении воды резко возрастает. [35]
Одновременное влияние ингибиторов кислотной коррозии на кинетику обеих электрохимических реакций приводит к тому, что стационарные потенциалы металлов изменяются незначительно. Сместить потенциал металла к значениям, при которых становится возможным формирование пассивирующего окисла, органические ингибиторы в кислотах сами по себе не в состоянии. Преимущественно их действие заключается во влиянии на кинетику катодной реакции разряда ионов гидроксония. При этом, как было показано в работе [59], как катионоактивные, так и анионоактив-ные добавки увеличивают перенапряжение водорода на железе, платине и меди. Это, на первый взгляд, противоречит тем теоретическим воззрениям на природу фгпотенциала, которые были выше изложены. Согласно теории, катионоактивные добавки должны повышать перенапряжение водорода, а анионоактивные - его понижать. [36]
Это представление не соответствует действительности. При изменении потенциала электрода в отрицательную сторону вначале достигается потенциал разряда ионов гидроксония, который в нейтральном растворе при р 1 атм равен всего - 0 4 в, и начинается указанный выше процесс выделения газообразного водорода. [37]
В работе [85] наряду с ацетоном были исследованы масляный и кротоновый альдегиды. Авторы считают, что процесс электрогидрирования протекает через адсорбированный водород, который появляется на электроде в результате разряда ионов гидроксония. В зоне до обратимого водородного потенциала электрогидрирование этих веществ протекает по водородному механизму. Раскрывая механизм адсорбции ацетона ( а также масляного и кретонового альдегидов), авторы [232] приходят к выводу, что между органическими молекулами и металлом имеет место электронное взаимодействие; в растворе кислоты лучше всего адсорбируется ацетон, хуже - кротоновый альдегид. [38]
Не меньшее влияние поляризация оказывает на работу химических источников электрической энергии - гальванических элементов и аккумуляторов. Водород на положительном электроде также выделяется с заметным перенапряжением, которое зависит от величины отбираемого тока, свойств полярной жидкости, материала электрода и состояния его поверхности. Наиболее часто поэтому для источников электрической энергии используют такие системы, в которых на положительных электродах вместо разряда ионов гидроксония протекает процесс восстановления какого-либо окислителя. [39]
Для построения кинетической кривой адсорбции органического вещества необходимо проведение опытов по электрогидрированию молекул этого вещества, находящихся в адсорбированном состоянии. Потенциал электрода-катализатора доводят до 0 5 - Н 0 6 в, вносят органическое вещество, через 15 - 20 минут сливают раствор, промывают несколько раз электролитом и, наполнив окончательно ячейку электролитом, снимают катодную кривую до достижения обратимого водородного потенциала. В данном случае изучалась реакция электрогидрирования в адсорбционном слое органического вещества между молекулами последнего и атомами водорода, которые получаются при разряде ионов гидроксония. [40]
Для построения кинетической кривой адсорбции органического вещества необходимо проведение опытов по электрогидрированию молекул этого вещества, находящихся в адсорбированном 1 состоянии. Потенциал электрода-катализатора доводят до 0 5 - г 0 6 в, вносят органическое вещество, через 15 - 20 минут сливают раствор, промывают несколько раз электролитом и, наполнив окончательно ячейку электролитом, снимают катодную кривую до достижения обратимого водородного потенциала. В данном случае изучалась реакция электрогидрирования в адсорбционном слое органического вещества между молекулами последнего и атомами водорода, которые получаются при разряде ионов гидроксония. [41]
Это явление неопровержимо доказывает переход ионов меди в гидратированное состояние при соприкосновении с водой. Значит, при разряде ионов меди необходимо затратить работу на отрыв от них молекул воды, входящих в гидратную оболочку. Таким образом, и в этом случае имеется препятствие на пути электрохимической стадии разряда. Оно, правда, слабее препятствия, возникающего при разряде ионов гидроксония, но при соответствующих условиях вполне способно превратить стадию разряда ионов меди в наиболее медленную стадию электрохимического процесса. [42]
Страницы: 1 2 3